9 клас
Вчитель хімії Янкович Оксана Олександрівна
моб. 0955011502
08.04
Тема: Вуглеводи: глюкоза, сахароза, крохмаль, целюлоза. Молекулярні формули, фізичні властивості поширення і утворення в природі.
Повторення (усно)
1. Що вивчає органічна хімія?
2. Які речовини називаються органічними? Наведіть приклади.
3.Завдяки яким особливим властивостям Карбону можливе існування величезної кількості органічних сполук?
4. Які класи органічних сполук вам уже відомі?
5. Назвіть відомі вам функціональні групи.
6. Назвіть класи оксигеновмісних органічних сполук.
Вивчення нового матеріалу
Вуглеводи – життєво важливі речовини, які необхідні кожному організму. Вони становлять 80% маси сухої речовини рослин і близько 2% сухої речовини організмів тварин. Тварина і людина не здатні синтезувати вуглеводи, вони отримують їх з різними харчовими продуктами. За добу дорослій людині необхідно споживати 400-500г вуглеводів.
Вуглеводи входять до складу нуклеїнових кислот, які здійснюють біосинтез білка й передачу спадкових ознак.
Вуглеводи – органічні речовини, молекули яких складаються з атомів С, Н і О
і відповідають загальній формулі Cn (H2O)m у якій певна кількість атомів Карбону пов’язана з деякою кількістю молекул води. Подальші дослідження показали, що назва «вуглеводи» неточна. По-перше, були знайдені вуглеводи, склад яких не відповідає цій формулі. По-друге, відомі, сполуки, склад яких відповідає загальній формулі вуглеводів, але за властивостями вони такими не є, наприклад, оцтова кислота.
Задача
Аналізом встановлений кількісний склад глюкози:
С – 40%, О – 53,3%, Н – 6,7%
Виведіть молекулярну формулу глюкози,з урахуванням, що Mr (глюкози) = 180.
| Дано: W(С)=40%=0,40 W(О)=53,3%=0,533 W(Н)=6,7%>0,067 Mr(глюкози)>180 |
W = n = ;
п (С) = = 6
п (О) = = 6
п (Н) = = 12 C6 H12 O6
|
| п (С) - ? п (О) - ? п (Н) - ?
|
Узагальнення
Тести
- До вуглеводів належать:
а) білки
д) поліетилен
м) моносахариди
- Моносахаридами є:
о) глюкоза
і) глікоген
з) мальтоза
- Якісний і кількісний склад глюкози виражається хімічною формулою:
н) C6H10О5
л) C6H12О6
а) Cn(H2О)m
- І крохмаль і глікоген є представниками:
в) поліаміди
б) дисахаридів
о) полісахаридів
- Масові частки елементів однакові в речовинах:
д) глюкоза C6H12О6 і фруктоза C6H12О6
е) фруктоза C6H12О6 і рибоза C5H10О5
о) рибоза C5H10О5 і дезоксирибоза C5H10О4
- Глюкоза за складом молекули є:
к) багатоатомним спиртом
ц) альдегідоспирт
л) альдегідом
- Речовини, що відповідають формулі Cn(H2О)m, і належать до вуглеводів:
і) C12H22О11
м) CH3СООН
о) С2Н5ОН
Домашнє завдання
Опрацювати поданий матеріал та параграф 36,37. Впр. 461.
01.04, 06.04
Жири.Склад жирів, фізичні властивості. Природні й гідрогенізовані жири. Біологічна роль.
Повторення
Дайте відповіді на питання
1. Які сполуки називаються карбоновими кислотами?
2. Які карбонові кислоти відносяться до вищих?
3. Як називаються сполуки, що утворюються при взаємодії карбонових кислот із спиртами?
4. Яка загальна формула карбонових кислот?
5. Формула гліцерину.
6. Формула стеаринової кислоти.
7. Формула олеїнової кислоти.
Вивчення нового матеріалу
Перегляньте відео - урок за посиланням:
Жири – естери трьохатомного спирту гліцерину та вищих карбонових кислот.
Утворення жирів
Жири – продукти реакції етерифікації:
СН2 ─ ОН НООС-R1 CН2 ─ О ─ СО ─R1
│ │
СН ─ ОН + НООС-R2 → CН ─ О ─ СО ─R2 + 3Н2О
│ │
СН2 ─ ОН НООС-R3 CН2 ─ О ─ СО ─R3
Глицерин карбонові жир
кислоти
Фізичні властивості жирів
Тваринні жири – тверді ( виняток – риб’ячий жир),
Рослинні жири – рідкі ( виняток – кокосове масло).
Легші за воду.
Нерозчинні у воді, але розчиняються в органічних розчинниках, наприклад, в бензині.
Добре вбирають запахи, (тому застосовуються в парфумерії).
Хімічні властивості жирів
- Реакції окиснення
Під час тривалого зберігання на повітрі під дією тепла і світла жири гіркнуть, з’являється неприємний запах і смак.
- Реакції гідролізу (омилення)
Відбувається під час перетравлення їжі в шлунку і кишечнику під дією ферментів. Продукти гідролізу всмоктуються в лімфу і кров, транспортуються в клітини, де і використовуються.
В пробірці гідроліз відбувається жиру з водою в присутності каталізаторів (кислоти, лугу,тощо)
CН2 ─ О ─ СО ─ С17Н35 СН2 ─ОН
│ │
СН ─ О ─ СО ─ С17Н35+ 3Н2О → СН ─ ОН + 3 С17Н35СООН
│ │ стеаринова кислота
СН2 ─ О ─ СО ─ С17Н35 СН2 ─ ОН
Тристеарин (жир) гліцерин
Лужний гідроліз:
CН2 ─ О ─ СО ─ С17Н35 СН2 ─ОН
│ │
СН ─ О ─ СО ─ С17Н35+ 3NaОH → СН ─ ОН + 3 С17Н35СООNa │ │ натрій стеарат
СН2 ─ О ─ СО ─ С17Н35 СН2 ─ ОН (мило)
Тристеарин (жир) гліцерин
4.Гідрування жирів (реакція приєднання водню)
Оскільки у молекулах рідких жирів, на відміну від твердих, є подвійні зв’язки, то вони можуть вступати в реакцію гідрування. В результаті цієї реакції ненасичена сполука перетворюється на насичену. А рідкий жир – на твердий.
CН2 ─ О ─ СО ─ С17Н33 СН2 ─О ─ СО ─С17Н35
│ │
СН ─ О ─ СО ─ С17Н33+ 3Н2 → СН ─ О ─ СО ─ С17Н35
│ │
СН2 ─ О ─ СО ─ С17Н33 СН2 ─ О ─ СО ─ С17Н35
триолеїн (рідкий жир ) Тристеарин (твердий жир)
Продукт гідрування використовується для одержання маргарину. Вихідна сировина – олія, риб’ячий та китовий жири
Значення жирів
1Жири – джерело енергії
1г жиру + О2 → СО2 + Н2О + 37,7 кДж
- Жири входять до складу клітинних компонентів, зокрема мембран.
- Жири виконують захисну функцію. Захищають від механічних пошкоджень, втрати тепла (у кита під шкірою шар жиру товщиною 0,5 м.)
- Жир – джерело води в організмі.
![]() 1кг жиру О 1,1кг Н2О
1кг жиру О 1,1кг Н2О
- Жири – технічна сировина (1/3 частина жирів перетворюється на гліцерин, мила, карбонові кислоти тощо)
- Жири – головний будівельний матеріал для дитячого мозку, що розвивається.
- За відсутності в їжі достатньої кілдькості жирів порушується діяльність центральної нервової системи, послаблюється імунітет.
- Жири роблять шкіру гладенькою і еластичною, волосся – здоровішим і блискучішитм.
Застосування жирів:
- харчова промисловість;
- маргарин;
- у домашніх умовах;
- мило;
- гліцерин;
- медицина;
- оліфа;
- косметичні засоби.
Оливкова олія використовується для лікування гастритів, язв, захворювань печінки, жовчних протоків, шлунка. Вершкове масло не виключати з раціону при захворюваннях нирок, атеросклерозом, гіпертонічною хворобою. Жири ми використовуємо у своєму раціоні.
Узагальнення
Тести
1. До якого класу сполук належать жири за своєю хімічною природою:
А) солі;Б) естери;В) карбонові кислоти;Г) спирти.
2. У результаті якої реакції утворюються жири:
А) окиснення;Б) приєднання;В) етерифікації;Г) гідролізу.
3. Чим відмінні і чим подібні тваринні та рослинні жири за
А) складом;Б) фізичними властивостями;В)хімічними властивостями .
4. Виберіть реакцію, характерну для тристеарину:
А) гідроліз;Б) гідрування;В) окиснення;
Г) знебарвлення розчину калій перманганату.
5. Якщо жир потрапив на ваш одяг, як можна зняти пляму:
А) водою;Б) кислотою;В) бензином;Г) лугом.
Домашнє завдання
Опрацювати параграф 35
30.03
Вищі карбонові кислоти: стеаринова, пальмітинова, олеїнова. Мило йго склад, мийна дія.
Перегляньте відео - урок
Вищими карбоновими кислотами (скорочено ВКК) називають карбонові кислоти, у молекулах яких міститься від 12 до 22 атомів Карбону. Як і вуглеводні, вищі карбонові кислоти можуть бути насиченими та ненасиченими.
З насичених ВКК найчастіше трапляються стеаринова С17Н35СООН й пальмітинова кислоти С15Н31СООН. (див. ст. 190)
Ненасичені – олеїнова С17Н33СООН та інші (див. ст. 190)
Солі ВКК використовують у виготовленні мила. Звичайне господарське мило на 72% складається із солей ВКК.
Мийна дія мила (опрацьовуємо у підручнику ст.192-193.
Виконуємо №419
2С17Н35СООК + СаСІ2 → (С17Н35СОО)2Са + 2НСІ
№415
До одноосновних, оскільки містять по одній карбоксильній групі СООН.
Домашнє завдання: опрацювати §34
25.03
Практична робота №4. Властивості етанової кислоти.
Повторюємо правила безпеки на ст. 189
Для виконання роботи користуйтесь відео- уроком:
Зробіть висновки
Домашнє завдання
Повторити параграф 33. Впр. 402.
18.03, 22.03
Хімічні властивості етанової кислоти: електролітична дисоціація, дія на індикатори,взаємодія з металами, лугами, солями. Застосувння етанової кислоти.
 .
.Карбонові кислоти — слабкі електроліти і слабкі кислоти. Найсильніша з них, метанова, відноситься до кислот середньої сили. Зі збільшенням числа атомів Карбону в молекулі сила кислот зменшується.
У хімічних реакціях з багатьма речовинами утворюються солі карбонових кислот. Солі мурашиної кислоти — форміати (метаноати), солі оцтової кислоти — ацетати (етаноати).
- Змінює забарвлення індикаторів.

- Взаємодіє з деякими металами (Al, MgMg,Zn,Al) з виділенням водню і утворенням солей (етаноатів, або ацетатів):

 .
. 
- Реагує з основними оксидами з утворенням солі і води:

 .
. 
- Вступає у реакцію нейтралізації з основами:

 .
. 
- Взаємодіє з карбонатами. Реакція відбувається з виділенням вуглекислого газу:



Застосування етанової кислоти
Є відмінним консервантом, тому застосовується для консервування харчових продуктів.
З етанової кислоти отримують гербіциди для боротьби з бур'янами.
Домашнє завдання
Опрацювати поданий матеріал та параграф 33
16.03
Етанова (оцтова ) кислота, її молекулярна і структурна формули, фізичні властивості.
Молекулярна формула – СН3-СООН.
Так, як кислота має два атоми Карбону, називається етанова. Кислота, яка має один атом Карбону – метанова (НСООН).
Більшість карбонових кислот мають традиційні назви. Наприклад, назва етанової кислоти – оцтова, метанової – мурашина.
Фізичні властивості див. ст 184.
Виконуємо №401
Дано: Розв’язання
V(розчину)=750мл Густина розчину дорівнює густині води.
W1(кислоти)= 6% 750 мл = 750 г
![]() W2(кислоти)=70% W1(кислоти) = m(кислоти)· m(розчину)
W2(кислоти)=70% W1(кислоти) = m(кислоти)· m(розчину)
m( есенції) - ? m(кислоти) = m(розчину)· W1(кислоти)
V(води)- ? Підставляємо
m(кислоти) = 750г · 0.06 = 45г
Обчислюємо m (есенції)
m(есенції) = m(кислоти) : W2(кислоти) = 45г : 0.7 = 64.3 г
Обчислюємо масу води
m(води) = m(розчину) - m(есенції) = 750 г – 64.3 г = 685,7 г
Відповідь: m(есенції) = 64.3 г, V(води) = 685,7 мл
Домашнє завдання
Опрацювати параграф 33.
11.03
Тема. Отруйність метанолу й етанолу. Згубна дія алкоголю на організм людини.
Повторення
Тестовий контроль. (в зошит)
Загальна формула насичених одноатомних спиртів:
а)С п Н 2п+2 О г) С2 Н5 ОН
б) С п Н2п+1 ОН в) С п Н2п-2
2. Функціональна група спиртів – це:
а) група атомів СООНб) група атомів ОН
в) група атомів СОНг) група атомів NО2
3. Ізомерія. не властива для одноатомних насичених спиртів:
а) будови карбонового ланцюга;
б) положення функціональної групи; в) просторова.
4. Біологічні властивості етанолу:
а) нетоксичний, б) наркотична речовина,
в) сильна отрута,г) снодійне.
5. Укажіть, які фізичні властивості характерні для етанолу:
а) в’язка рідина,б) добре розчиняється уводі.
в) має солодкий смак,г) має специфічний запах.
6. Укажіть якісний реактив на етанол:
а) калій перманганат, б) хромова суміш,
в) натрій,г) бромна вода.
7. Атоми яких хімічних елементів обов’язково присутні в усіх молекулах спиртів:
а) С, N, Н, б) С, О, Н, в) С, Н, Сl
8. Зі збільшенням вуглеводневого радикала розчинність спиртів у воді:
а) збільшується, б) зменшується, в) не змінюється, г) спочатку збільшується, а потім зменшується.
9. Найбільшу розчинність у воді має:
а) метанол,б) бензин, в) пропанол, г) бутанол.
10. Укажіть молекулярну формулу етанолу:
а) С3Н7ОН, б) С2Н5ОН, в) С2Н5СОН, г) СН3ОН.
Вивчення нового матеріалу
Історичні відомості про алкоголь та його виробництво
Чистий спирт почали одержувати в VІ столітті араби, які називали його «аль коголь», що означає «одурманюючий». Першу пляшку горілки виготовили араби до 860 р. Перегонка вина з метою одержання спирту різко збільшила кількість п’яниць. Не виключено, що саме це й стало приводом до заборони вживання спиртних напоїв, до якої вдався основоположник ісламу Магомет. Відтоді в мусульманських країнах алкоголю не вживали. А відступників від цього закону жорстоко карали.
За часів Середньовіччя у Західній Європі також навчилися одержувати міцні напої, переганяючи вино та інші цукристі рідини, які мають здатність бродити. За легендою, алхімік Валеніус, який одержав спирт, заявив, що він знайшов чудесний еліксир, який старого робить молодим, стомленого – бадьорим, зажуреного – веселим. Злу силу алкоголю розуміло багато людей. Відомий релігійний реформатор Мартін Лютер писав: «Кожна країна повинна мати свого диявола: наш німецький диявол – добра бочка вина». Поширення пияцтва на Русі пов’язане з політикою панівних класів. Виникла навіть думка, що пияцтво є нібито стародавньою народною традицією. При цьому посилалися на слова літопису «Веселість на Русі». Але це наклеп на нашу історію. Відомий історик Костомаров повністю спростував цю думку. Він довів, що в Стародавній Русі пили мало. Лише на великі свята варили мед, брагу,пиво, міцність яких не перевищувала 5 – 10 градусів. У будні жодних спиртних напоїв не вживали, й пияцтво вважалося великим гріхом, ганьбою. Життя показало, що заборона продажу спиртних напоїв у деяких країнах не тільки не сприяє зменшенню алкоголізму, але й у деяких випадках – збільшенню пияцтва.
Боротьба з алкоголізмом має таку ж давню історію, як і самі спиртні напої. У Стародавній Греції пити нерозведене водою вино ( міцність його не перевищувала 10 градусів_ вважалося недостойним вільного громадянина. Правитель Спартизаборонив пити вино вищій знаті держави, але заохочував споювання рабів, щоб тримати їх у покорі.
В Афінах правитель Соломон запровадив сухий закон, за яким службових осіб карали за пияцтво: вперше великим штрафом, а в разі повторення – стратою.
Давньоримський історик Пліній Старший писав про те, що перси та мідяни були переможені греками під керівництвом О. Македонського тому, що в них були розвинуті пияцтво та інші пов’язані з ним пороки.
Згубна дія алкоголю на організм людини.
Дослід: в пробірках міститься яєчний білок та шматок хліба, додаємо в пробірки, окремо, воду і розчин спирту. Спостерігаємо, що яєчний білок у воді розчиняється, а в спирті – згортається, шматок хліба у воді м’якшає і плаває на поверхні, а в спирті – твердне. Отже, спирт ослаблює й руйнує живі клітини. Саме на цій здатності спирту засноване його застосування в медицині як дезінфікуючого засобу.
Під час уживання алкоголь зі шлунка й кишечнику всмоктується в кров. Розподіляється із кров’ю по всьому організмові, він з руйнівною силою впливає на всі органи й системи людини. Особливо шкідливий він для нервових клітин, що зумовлюється легкою розчинністю алкоголю в жирових і жироподібних речовинах, які становлять основу нервової тканини. Проникаючи в нервову клітину, алкоголь розчиняє життєво важливі для неї ліпоїдні речовини, змінюючи її нормальну діяльність. У результаті одного сильного сп’яніння гине до 20 тисяч клітин головного мозку: унаслідок уживання 100 грам пива – 3 тисячі клітин, 100 грам вина – 5 тисяч клітин. За роки в питущої людини гинуть мільйони клітин, які не відновлюються. Тому в людей, які зловживають спиртним, послаблюється пам’ять, увага, притупляються моральні якості. Не менш небезпечним є вживання алкоголю і для інших органів.
Уживання алкоголю натщесерце має сильніший і швидший ефект, ніж уживання під час або після їжі. Їжа діє як буфер під час поглинання спиту. В організмі спирт окислюється до вуглекислого газу і води. При цьому вивільняється велика кількість енергії – 29,8 кДж/год. А за 1 год в печінці окислюється близько 10 мл спирту. Уведення спирту в організм порушує його теплоізоляцію внаслідок розширення шкірних кровоносних судин. Суб’єктивне відчуття тепла, пов’язане з цим явищем, насправді не супроводжується підвищенням температури тіла. Навпаки, організм утрачає теплоту, тому вживання спирту на холоді пов’язане з ризиком замерзти.
З’ясовано,що вплив алкоголю під час внутрішньоутробного розвитку призводить до недорозвинення плоду або окремих його частин, підвищення смертності, розвитку нервово – психічних розладів, захворювання органів травлення, серцево – судинної системи.
Метанол дуже небезпечний для людини. 10-20 мл цієї речовини можуть викликати сліпоту і смерть. Причиною тому є дія ще більш сильної отрути – формальдегід, що утворюється в організмі при окисненні метанолу.
Встановлено, що третина ДТП трапляється з вини людей, які перебувають у стані сп’яніння. Через це гине 57, 7 % загальної кількості потерпілих. Навіть малі дози алкоголю ( 25 – 50 г) сповільнюють реакцію, 100 г підвищують ризик удвічі. Швидкість реакції сповільнюється на 0, 5 с. Так, якщо людина буде рухатися зі швидкістю 60 км/год, то вона встигне зреагувати на перешкоди не менш як за 10 м.
Алкоголізм не дає людині можливості мати міцну життєвупозицію. Він веде до паразитичного способу життя, до постійного пошуку грошей, до злочинів. Установлено, що 55% крадіжок, 79 % пограбувань, 69 нападів здійснюється у стані сп’яніння.
Застосування метанолу й етанолу.
Спирти – важливий продукт, що застосовуються людиною. Використовуються як органічні розчинники, моторне паливо. Їх використовують для виробництва бутадієну, з якого згодом виготовляють синтетичний каучук. Зі спиртів одержують низку фармацевтичних препаратів, оцтову кислоту і фруктові есенції. Метиловий спирт використовують для одержання формальдегіду, необхідного для виробництва пластмас і фенол формальдегідних смол.
Домашнє завдання: повторити параграф 30-31.
09.03
ГОРІННЯ ЕТАНОЛУ. ЯКІСНА РЕАКЦІЯ НА ГЛІЦЕРОЛ.
Повторення
Виконання експрес – тестів ( в зошит)
- Виберіть функціональну групу спиртів:
А) –СООН; Б) -NH2; В) –СОН; Г) –ОН.
2. Які із даних речовин належать до спиртів:
А) СН3ОН; Б) С2Н5СООН; В) С2Н5ОН; Г) СН3СОН.
3. Відповідно до систематичної номенклатури в назвах спиртів є суфікс:
А) –ан; Б) –ен; В) –ін; Г) –ол.
4. Яка із наведених формул є формулою метилового спирту:
А) С2Н5ОН; Б) СН3ОН; В) С3Н7ОН; Г) С4Н9ОН.
5. Яка із наведених формул є формулою етилового спирту:
А) СН3ОН; Б) СН3 ─СН2 ─ ОН;
В) С3Н7ОН; Г) СН3 ─ СН2 ─ СН2 ─ ОН.
6. Які із перелічених нижче фізичних властивостей притаманні метиловому та етиловому спиртам:
А) тверда речовина; Б) добре розчинна у воді; В) без запаху; Г) гігроскопічна; Д) летка; Е) токсична речовина.
7. Із наведеного переліку фізичних властивостей виберіть ті, що характерні для гліцерину:
А) безбарвна рідина; Б) солодкувата на смак;
В) не розчиняється у воді; Г) летка;
Д) з характерним запахом; Е) токсична речовина.
8. Чому серед спиртів відсутні гази:
А) тому що в складі молекули є Оксиген;
Б) тому що молекули сполучаються між собою водневими зв’язками;
Г) науці це невідомо
Вивчення нового матеріалу
Хімічні властивості спиртів
1.Дія індикаторів. Спирти – нейтральні речовини.
2. Повне окиснення – горіння
2СН3ОН + 3 О2 → 2СО2 + 4Н2О + Q
С2Н5ОН + 3О2 → 2СО2 + 3Н2О + Q
3.Взаємодія з активними металами ( реакція заміщення)
2СН3ОН + 2Na→ 2СН3ОNa + Н2
Натрій метилат
2С2Н5ОН + 2Na→ 2С2Н5ОNa + Н2
Натрій етилат
СН2 – ОН СН2 - ОNa
│ │
2 СН – ОН + 6 Na → 2 CH – ONa + 3H2
│ │
СН2 – ОН CH2 – ONa
Натрій гліцерат
4. Взаємодія з галогеноводнями.
С2Н5ОН + HCl→ С2Н5Cl + Н2O
СН3ОН + HBr→ СН3Br+ Н2O
5.На відміну від одноатомних спиртів, багатоатомні спирти реагують з основами.
Якісна реакція на багатоатомні спирти – взаємодія із свіжо - осадженим купрум (ІІ) гідроксидом:
Гліцерин + Cu(OH)2 → прозорий розчин синього кольору
Фізіологічна дія метанолу і етанолу
Метанол:10 мл метанолу в організмі спричиню єсліпоту,25 мл – смерть.
Етанол:Речови нанаркотичного типу, щопригничує ЦНС.
За концентрації спирту в крові 1 – 2 г/л настаєсп'яніння,
>3 – 4 г/л – загальнаінтоксикація,
>5 – 8 г/л – смерть.
Для дітей летальна доза -3г на 1кг маситіла( близько 100г водки),
Для підлітків – 4 – 5г на 1кг маситіла( близько 0,5л водки),
Спирт легко розчиняється ішвидковсмоктуєтьсяв кров. 90% спирту затримуєтьсявпечінці, перетворюючися на альдегід (отрута). Цероз печінки –найчастіше це хвороба людей, що часто вживають алкоголь.
Наслідки частого вживання алкоголю:
- Послаблюється увага;
- Загальмовується реакція;
- Порушується координація рухів;
- З’являється розв’язаність;
- Алкоголізм;
- Порушення нервової системи, серцево-судинної, травної, статевої систем.
Узагальнення й закріплення знань
Розв’язок задач ( в зошит)
Задача №1
Калій масою 2,3г помістили в етанол. Який об’єм (н.у.) водню виділиться?
Задача №2
Скільки гідроксильних груп має молекула спирту, якщо при реакції 1 моль цього спирту з натрієм виділяється 2 моль газу?
Домашнє завдання .
Опрацювати параграф 31 -32. Записати конспек уроку в зошит.
лександрівна
моб. 0955011502
09.03
25.02
Метанол, етанол, гліцерол: молекулярні і структурні формули, фізичні властивості
Перегляньте презентацію та виконайте подані в ній завдання.
23.02
Тема уроку: Оксигеновмісні органічні речовини. Поняття про спирти, карбонові кислоти, жири, вуглеводи
Оксигеновмісні органічні речовини – це органічні сполуки, в молекулах яких крім С і Н міститься О.
Оксигеновмісні органічні речовини поділяються на класи – клас спиртів, клас карбонових кислот, клас жирів, клас вуглеводів тощо.
Спирти
Спирти–це органічні сполуки, до складу яких входить одна або декілька гідроксильних груп, сполучених з вуглеводневим радикалом.
Загальна формула одноатомних насичених спиртів – CnH2n+1OH.
Назви спиртів утворюються від назв відповідних вуглеводнів з додаванням суфікса -ол (наприклад етанол).
Метанол (деревний спирт) – це найпростіший одноатомний насичений спирт.
Етанол (винний спирт) – це спирт, добутий при спиртовому бродінні цукристих речовин.
Формула метанолу – CH3OH.
Формула етанолу – C2H5OH.
Карбонові кислоти
Карбонові кислоти–це органічні сполуки, до складу молекул яких входить карбоксильна функціональна група:-СООН.
Насичені одноосновні карбонові кислоти містять одну карбоксильну групу й ординарні карбон-карбонові зв'язки.
Загальна формула насичених одноосновних карбонових кислот: CnH2n+1COOH.
Міжнародні систематичні назви карбонових кислот утворюються від назв відповідних вуглеводнів із додаванням закінчення -ова і слова кислота. Наприклад, метанова кислота.
Метанова (щавелива) кислота – найпростіша одноосновна карбонова кислота.
Етанова (оцтова) кислота – найвідоміша з органічних кислот.
Формула метанової кислоти – НСООН.
Формула етанової кислоти – СН3СООН.
Жири
Жири– це клас органічних сполук, молекули яких складаються із залишківмолекул багатоатомного спирту гліцерилу та вищих карбонових кислот.
Загальна формула жирів можна представити так:
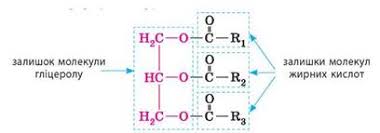
де ,R1,R2, R3–вуглеводневіланцюги у складі молекул вищих карбонових кислот; залежно від жиру вони можуть бути однаковими, а можуть бути й різними.
Вуглеводи
Вуглеводи – органічні сполуки із загальною формулою Cn(H2O)m(m,n> 3).Найвідоміші нам вуглеводи – це глюкоза та сахароза.
Глюкоза – найпоширеніший вуглевод у живій природі, саме вона є одним із продуктів фотосинтезу, в результаті якого рослини накопичують енергію Сонця.
Сахароза – важливий вуглевод, який використовують у побуті називають цукор.
Формула глюкози – С6Н12О6.
Формула сахарози – С12Н22О11
Узагальнення.
- Дайте визначення поняттям:
- Оксигеновмісні органічні речовини
- Спирти
- Карбонові кислоти
- Жири
- Вуглеводи
- Назвіть представників
- Спиртів
- Карбонових кислот
- Жирів
- Вуглеводів
Задача ( в зошит)
- Обчисліть масові частки Карбону й води: а) у глюкозі; б)у сахарозі. Яка з цих речовин більше багата на воду, а яка – на Карбон?
Домашнє завдання
Опрацювати параграф 30,33,34,35 скласти конспект.
18.02
Узагальнення : «Найважливіші органічні сполуки ч.1»
( виконані роботи надіслати на Viber до 20.02)
I варіант
1. . У молекулі етену між атомами Карбону утворюється зв’язок:
А) одинарний ; Б) подвійний; В) потрійний.
2. Речовини, подібні за будовою і хімічними властивостями, склад яких відрізняється між собою на одну або декілька – СН2 – груп, називаються:
- гомологами;
- вуглеводнями;
- ізомерами;
- полімерами.
3. Позначте загальну формулу алкенів:
- СnН2n+2
- СnН2n+1
- СnН2n-2
- СnН2n
4. Позначте структурну формулу, що відповідає гексану:
- СН3 – СН2 – СН2 – СН2 – СН2 – СН2 – СН3;
- СН3 – СН2 – СН2 – СН = СН2;
- СН3 – СН2 – СН3;
- СН3 – СН2 – СН2 – СН2 – СН2 – СН3.
5. Установіть послідовність розташування речовин в гомологічному ряді алканів:
- етан;
- гептан;
- бутан;
- нонан.
6. Установіть відповідність між реагентами та продуктами, укажіть умови перебігу реакції:
1. СН2 =СН2 + Br2 → a) 4CO2 + 6H2O;
2. CaC2 + 2H2O → б) С2Н4;
3. 2С2Н6 + 7O2 → в) C2H2 + Са(ОН)2;
4. C2H2 + H2→ г) CH2Br – CH2Br;
д) CH2Br.
7. Назвіть за систематичною номенклатурою вуглеводні, які мають будову:
СН3
׀
а) СН3 – СН2 – С– СН2 – СН3;
׀
СН3
б) СН3 – СН – СН2– СН = СН3.
׀
СН3
8. Складіть структурні формули таких сполук:
а) 2,2 –диметилпропану;
б) 2-метилпропену.
9. Розрахуйте об’єм бутіну (н.у.), що вступає у взаємодію з воднем об’ємом 11.2 л.
Узагальнення : «Найважливіші органічні сполуки ч.1»
( виконані роботи надіслати на Viber до 20.02)
II варіант
- Як називається реакція приєднання атомів Гідрогену:
А) гідрування;
Б) дегідрування;
В) гідратація;
Г) полімеризація.
- Речовини, що мають однаковий склад та відносну молекулярну масу, але відрізняються будовою молекул, називаються:
А) гомологами;
Б) ізомерами;
В) полімерами;
Г) вуглеводнями.
- Позначте загальну формулу алкінів:
А) СnH2n+2
Б) CnH2n+1
В) CnH2n-2
Г) CnH2n
- Позначте структурну формулу, що відповідає гептану:
А) CH3 – CH2 – CH2 – CH2 – CH2 – CH2 – CH3;
Б) CH3 – CH = CH – CH2 – CH3;
В) CH3 – CH = CH2;
Г) CH3 – CH2 – CH2 – CH2 – CH2 – CH3.
- Установіть послідовність розташування речовин в гомологічному ряді алканів:
А) октан;
Б) гексан;
В) бутан;
Г) декан.
- Установіть відповідність між реагентами та продуктами, укажіть умови перебігу реакції:
А) CH2 = CH2 + H2 → 1) CO2 + H2O;
Б) CH ≡ CH + Br2 → 2) CH3 – CH3;
В) CH2 = CH2 + O2 → 3) CHBr – CHBr;
Г) СH4 + Cl2 → 4) CH3Cl + HCl;
5) CH3 – CH2Cl.
- Назвіть за систематичною номенклатурою вуглеводні, які мають будову:
А) C2H5
׀
CH3 – CH – CH – CH2 – CH3;
׀
CH3
Б) CH3
׀
CH ≡ C – C – CH2 – CH3.
׀
CH3
- Складіть структурні формули таких сполук:
А) 4-метилпент-2-ен; Б) 2,3-диметилбутан.
9. .Розрахуйте об’єм вуглекислого газу (н.у.), що утвориться при спалюванні 5,2 г ацетилену
16.02.
Перегонка нафти. Вуглеводнева сировина йохорона довкілля. Застосування вуглеводнів.
Дивитись відео:
Домашнє завдання: Опрацювати поданий матеріал та параграф 29, виконати завдання 343, 349 стр. 171. Підготуватись до контрольної роботи, повторити параграфи 22- 29.
11.02
Тема уроку: Поширення вуглеводнів у природі. Природний газ, нафта, кам’яне вугілля – природні джерела вуглеводнів.
Хід уроку
Актуалізація опорних знань.
Дайте відповіді на питання
1. Які речовини називають полімерами? Які їхні відмінні ознаки від інших матеріалів?
2. Щоспільногоміж мономером і елементарною ланкоюполімеру? Чим вони відрізняються?
3. Дайте визначенняпоняттям «реакція полімеризації», «мономер», «полімер», «ступіньполімеризації» та «елементарна ланка».
чомухімічнівластивостіполіетиленувідрізняютьсявідвластивостейетилену.
Вивчення нового матеріалу.
Нафта, природний гази й кам’яне вугілля — основні джерела вуглеводнів. Під час їх переробки можна одержати майже всі органічні сполуки, що використовуються людьми. Об’єми видобутку вуглеводнів збільшуються щороку, але ще швидше збільшується потреба в них. Якщо раніше основну їх частину використовували тільки у вигляді палива, то зараз акценти зміщаються в напрямку їх переробки й одержання нових органічних речовин: синтетичні волокна, штучне хутро, барвники, розчинники, різні види палива, лікарські препарати, мастила, пластмаси, каучуки, будівельні матеріали тощо. Просто спалювання газу, нафти, вугілля економічно вкрай не вигідно. До того ж продукти спалювання природних вуглеводнів забруднюють атмосферу. Тому щороку дедалі активніше відбувається пошук альтернативних джерел енергії.
Нафта — одна з найважливіших корисних копалин. Неможливо уявити сучасне суспільство без нафти й продуктів її переробки. Недарма країни, багаті на нафту, відіграють важливу роль у світовій економіці.
Нафта — це темна масляниста рідина, що залягає в земній корі на різній глибині. Вона являє собою однорідну суміш із кількох сотень речовин — переважно насичених вуглеводнів із числом атомів Карбону в молекулі від 1 до 40. Для переробки цієї суміші використовують як фізичні, так і хімічні методи.
Природний газ
Друге за важливістю джерело вуглеводневої сировини — це природний газ, головною складовоюякого є метан (93-99 %). Природний газ використовують насамперед як ефективне паливо. Під час його згоряння не утворюється ані зола, ані отруйний чадний газ, тому природний газ уважають екологічно чистим паливом.
Великукількість природного газу використовує хімічна промисловість. Переробка природного газу зводиться переважно до добування ненасичених вуглеводнів і синтез-газу. Етилен і ацетилен утворюютьсяпід час відщеплення водню від нижчих алканів:
С2Н6 C2H4 + H2
Синтез-газ — суміш карбон(ІІ) оксиду й водню — добувають нагріванням метану з водяною парою:
СН4+H2O CO + 3H2
Із цієї суміші, застосовуючи різні каталізатори, синтезують окси-геновмісні сполуки — метиловийспирт, оцтову кислотутощо.
Під час пропускання над кобальтовим каталізатором синтез-газ перетворюється на суміш алканів, що являє собою синтетичний бензин:
nCO + (2n+1)H2 → CnH2n+2 + nH2O
Кам'яне вугілля
Ще одним джереломв углеводнів є кам’яне вугілля. У хімічній промисловості його переробляють шляхом коксування — нагрівання до 1000 °С без доступу повітря (мал. 29.5, с. 170). При цьому утворюються кокс і кам’яно вугільна смола, масса якої становить лише кілька відсотків від маси вугілля. Кокс використовують як відновник у металургії (наприклад, для добування заліза з його оксидів).
Кам’яновугільна смола містить кілька сотень органічних сполук, переважно ароматичних вуглеводнів, які виділяють з неї перегонкою.
Кам’яне вугілля також використовують як паливо, однак при цьому виникають значні екологічні проблеми. По-перше, вугілля містить негорючі домішки, які під час згоряння палива перетворюються на шлаки; по-друге, у складі вугілля є невеликі кількості сполук Сульфуру й Нітрогену, під час згоряння яких утворюються оксиди, що забруднюють атмосферу.
Україна за запасами вугілля посідає одне з перших місць. На території, що дорівнює 0,4 % від світової, в Україні зосереджено близько 5 % світових запасів енергетичної сировини, 95 % з яких припадає саме на кам’яне вугілля (близько 54 млрд тонн). 2015 року видобуток вугілля становив 40 млн тонн, що майже вдвічі менше, ніж 2011 року. Сьогодні в Україні є 300 кам’яновугільних шахт, при чому 40 % з них добувають коксівне вугілля (те, що можна переробляти на кокс). Видобуток зосереджений переважно в Донецькій, Луганській, Дніпропетровській та Волинській областях.
Закріплення знань.
Скласти схему використання різних видів природної вуглеводневої сировини.( в зошит)
Домашнє завдання.
Вивчити параграф 29., скласти та записати конспект.
21. 01
Тема:Метан як представник насичених вуглеводнів. Гомологія.
Актуалізація опорних знань.
Гра «Так чи ні»
1.Органічна хімія – це хімія сполук Карбону .
2. Карбон в органічних сполуках завжди чотири валентний .
3.На зовнішньому енергетичному рівні атома Карбону міститься 6 електронів
4. В основному стані в атомі Карбону 4 неспарені електрони
5. В збудженому стані в атомі Карбону 2 неспарені електрони .
6. Атоми Карбону здатні утворювати як йонні, так і ковалентні сильно полярні зв’язки
7. Атоми Карбону здатні утворювати між собою міцні ковалентні зв’язки і з’єднуватися в довгі ланцюжки або цикли .
8. Основні положення теорії хімічної будови органічних речовин сформулював Д.І. Менделєєв
9. Хімічна будова - це послідовність з’єднання атомів відповідно до їхньої валентності в молекулі .
10. Властивості речовин залежать тільки від того, атоми яких елементів і в якій кількості утворюють молекулу
11. Структурні формули – це такі формули, в яких символи хімічних елементів сполучаються рисочками, кількість яких дорівнює валентності елемента в сполуці
12. Ізомери – це речовини,що мають однаковий склад, але різну будову
13. Ізомери – це речовини, що мають однакові властивості .
14. Структурні формули бувають розгорнуті та скорочені
15. До складу вуглеводнів входять С, Н, О та іноді інші елементи
Для вивчення нового матеріалу та домашнього завдання користуйтесь презентацію за посиланням :
/uploads/editor/5002/403421/sitepage_177/files/prezentaciya_9_klas.ppt
19.01. 2021
Тема: Особливості органічних сполук (порівняно з неорганічними). Улементи-органогени.
Повторення
Усно
Назвіть фізичні властивості речовин.
Від чого вони залежать?
Вивчення нового матеріалу.
Дивитись презентацію:/uploads/editor/5002/403421/sitepage_177/files/4805.pptx
1) Предмет органічної хімії та її виникнення як науки.
Ви вже знайомі з багатьма хімічними речовинами і знаєте, що їх можуть утворювати атоми майже будь-яких хімічних елементів.
Органічні сполуки (ОС) кожна сполука обов’язково містить атоми Карбону. Саме тому розділ хімії, що вивчає органічні речовини (ОР), називають не лише органічною хімією (ОХ) а й хімією сполук Карбону.
Кількість природних і синтетичних органічних сполук величезна - наразі їх відомо близько 30 млн. Порівняйте: кількість неорганічних сполук трохи більша за 0,6 млн. Хіміки творятьорганічний дивосвіт, аби вдовольнити потреби людства в нових матеріалах і технологіях. Щодня в лабораторіях синтезують або видобувають з природних об'єктів усе нові й нові органічні речовини, досліджують їх.
З давніх часів людина була обізнана з деякими ОС, способами їх добування та використання. Це стосується жирів, оцтової кислоти, спирту, органічних барвників тощо.
Саме природні об'єкти від найдавніших часів були джерелом органічних сполук. Із золи рослин, тваринних і рослинних жирів варили мило. З розвитком ремесел і науки було винайдено способи переробки рослинної сировини на оцет і спирт, які застосовували в медицині.
Однак у лабораторних умовах довго не вдавалося добути ОР, що входять до складу живих організмів.
Тривалий час поміж природодослідників побутували уявлення пре особливу «життєву силу» - причину утворення органічних речовин в живих організмах. Уважалося, що синтез цих сполук (на відміну від неорганічних) поза тваринними чи рослинними організмами неможливий.
Згодом з'ясувалося, що органічні речовини можна синтезувати в лабораторних умовах поза живими організмами. У 1824 р. Ф. Велер синтезував щавлеву кислоту з неорганічних сполук, А в 1828 р. – сечовину. Це було крахом теорії віталізму.
В наші часи органічними називають як природні, так і синтетичні сполуки Карбону. Вони відіграють величезну роль у природі, тому що життя на Землі пов’язане з їхнім виникненням і перетворенням.
Природні орг. сполуки є рослинного і тваринного походження.
ОС становлять основу харчових продуктів, здавна застосовуються як сировина для виготовлення тканин, входять до різних видів палива.
У сучасному світі є незамінними синтетичні високомолекулярні сполуки.
ОС мають деякі спільні ознаки з НС.
- Можуть перебувати в різних агрегатних станах
- Вступають у різні типи відомих вам з НХ хімічних реакцій
- Є постійними учасниками процесу обміну у живій природі
- Фізичні властивості характеризуються тими самими ознаками
Але між О і Н речовинами є чимало відмінностей.
Розвиток науки і промисловості спонукали науковців дослідити елементний склад і властивості органічних сполук порівняно з неорганічними. Було підмічено, що органічні речовини горючі й, істотно поступаючись термостійкістю неорганічним сполукам, обвуглюються за нагрівання. Виявилось, що до складу всіх досліджених органічних речовин входять Карбон і Гідроген. Чимало з-поміж органічних сполук містили Оксиген, а деякі - Нітроген і Фосфор. Ці елементи називають елементами –органогенами.
Майже всі ОС є речовинами молекулярної будови, тобто складаються з молекул.
Основою ОС є Карбон. В ОС він чотиривалентний .На відміну від інших хімічних елементів властивості атомів Карбону дозволяють йому утворювати величезну кількість сполук, різноманітних за властивостями і функціями. Різноманітність ОС пояснюється
- здатністю атомів Карбону утворювати міцні хімічні зв’язки між собою, тобто з’єднуватись в довгі ланцюжки або цикли
- різні зв’язки: одинарні, подвійні, потрійні.
Сполуки, які містять тільки одинарні зв’язки С- С, називають насиченими. Вони містять максимально можливе при даному скелеті число атомів Гідрогену, тобто насичені Гідрогеном. Сполуки зі зв’язками С=С називають ненасиченими.
- Наявність речовин з однаковим кількісним і якісним складом, але різною будовою (ізомерів)
Узагальнення
Закінчить речення ( в зошит)
До складу ОР обов’язково входить …
Карбон в ОС завжди має валентність …
До елементів –органогенів належать …
Атоми Карбону здатні з’єднуватись в …
За будовою карбонового скелету ОС поділяються на …
ОР мають будову …
При повному спалюванні ОР утворюються …
Домашнє завдання
1.Опрацювати матеріал параграфа 22. Впр. 253 ст. 137.
2. Скласти опорний конспект.
14.01. 2021
Тема: Швидкість хімічної реакції, залежність швидкості реакції від різних чинників.
Нові поняття і терміни: швидкість хімічної реакції, інгібітори.
Повторення
|
Скласти термохімічне рівняння утворення хлороводню з простих речовин, якщо при цьому виділяється 91,5 кДж/моль теплоти
|
2. Гра «Вірю – не вірю»
Учні зачитують твердження і дають відповідь - вірне воно чи хибне.
- Екзотермічні реакції відбуваються із виділенням теплоти.
- Ендотермічні реакції відбуваються із поглинанням теплоти.
- Реакція горіння вугілля – це ендотермічна реакція.
- Тепловий ефект реакції – це маса продукту реакції, що утворилася під час горіння речовини.
- Тепловий ефект реакції вимірюється в паскалях (Па), або кілопаскалях(кПа).
- Тепловий ефект реакції позначається буквою Q або ∆Н.
- В ендотермічних реакціях внутрішня енергія речовин зростає.
- Тепловий ефект реакції – це кількість теплоти, що виділяється, або поглинається під час реакції.
- Тепловий ефект реакції вимірюється в Дж або кДж.
- Хімічні рівняння, в яких зазначаються ступені окиснення елементів, називаються термохімічними.
- При екзотермічних реакціях температура реакційної системи підвищується.
12.Під час протікання ендотермічної реакції температура реакційної суміші підвищується.
Вивчення нового матеріалу.
- Вивчаючи хімічні властивості різних сполук, ви напевне звернули увагу на те, що для перебігу різних реакцій потрібний різний час:
- Іржа на залізних виробах утворюється за кілька місяців;
- Горіння свічки триває кілька годин;
- Реакція між содою і оцтом відбувається в одну мить.
- Отже, реакції перебігають з різною швидкістю. Пригадайте, як на уроках фізики і математики, ви позначали швидкість руху? (U)
- Швидкість хімічних реакцій вивчає розділ хімії, що називається хімічною кінетикою.
- За якими критеріями можна судити про швидкість протікання хімічної реакції? За зміною кількості вихідних речовин і продуктів реакції.
Швидкість реакції – зміна концентрації речовини за одиницю часу.
С2 – С1 ∆C ∆υ
U = + = + або U =
τ 2 – τ 1 ∆ τ V ∆ τ
C - молярна концентрація, [моль/л]
τ1 і τ 2 - початковий і кінцевий час хімічної реакції, [c]
U – швидкість хімічної реакції, [моль/л∙с]
V - об’єм, [л]
υ – кількість речовини, [моль]
Чому перед формулою ставлять +? Якщо швидкість обраховують за зміною концентрації вихідних речовин, то ставиться «-», бо ∆C набуває від’ємного значення, а якщо за зміною концентрації продуктів реакції, то ставиться +.
5.В житті часто виникає потреба керувати швидкістю реакції . Наприклад,
- горіння палива прискорювати;
- пожежу – сповільнювати;
- іржавіння заліза сповільнювати.
Вплив різних факторів на швидкість хімічної реакції ( таблиця в зошит)
| Фактори, які впливають на швидкість реакції | Хімічний експеримент, спостереження | Висновок |
| Природа реагуючих речовин | Cu + HCl → - реакція не відбувається Zn + 2HCl → ZnCl2 + H2 – відбувається повільно Mg + 2HCl → MgCl2 + H2 – відбувається швидко
| Чим активніша речовина, яка вступає в реакцію, тим швидше відбувається реакція |
| Ступінь подрібнення речовини | СаСО3 шматок + 2HСl → CaCl2 + CO2 + H2O реакція відбувається повільно
СаСО3 порошок + 2HСl → CaCl2 + CO2 + H2O реакція відбувається швидко | Чим більша поверхня стикання реагентів, тим більша швидкість реакції |
| Концентрація реагуючих речовин. | Zn + 2HClрозвед. → ZnCl2 + H2 – відбувається повільно
Zn + 2HCl концентр. → ZnCl2 + H2 – відбувається швидко
| Чим більша концентрація реагуючих речовин, тим швидше відбувається реакція. |
| Температура | Zn + 2HCl . → ZnCl2 + H2 – відбувається повільно t Zn + 2HCl. → ZnCl2 + H2 – відбувається швидко
| При нагріванні швидкість реакції зростає. |
| Наявність каталізатора або інгібітора | Відео досліди: MnO2 2Н2О2 → 2Н2О + О2
H2O 2Al + 3I2 → 2AlI3 | Каталізатори – прискорюють швидкість реакції Інгібітори - сповільнюють швидкість реакції
|
Узагальнення
Дайте відповіді на питання
- За допомогою якого фактора можна прискорити реакції між газами.
2.Чому не можна під час пожежі відкривати вікна?
Домашнє завдання:
§ 20,21. Вправа 247, 248
Творче завдання:
Підготувати повідомлення на тему: Значення каталізаторів у техніці.
12.11, 17.11
Йонно – молекулярні ріняння хімічних реакцій
Повторення
Дайте відповіді на питання
- Які речовини називаються електролітами?
- Що таке не електроліти?
- Який вчений запропонував поділити речовини на електроліти і не електроліти?
- Які речовини (класи сполук) належать до електролітів?
- Які речовини належать до не електролітів?
- Який тип зв’язку характерний для речовин – електролітів?
- Який тип зв’язку характерний для речовин – неелектролітів?
Вивчення нового матеріалу
Дивитись відео :https://www.youtube.com/watch?v=mVg0tePFsvA
Виконання завдань на закріплення знань
Закінчіть молекулярне рівняння реакцій, напишіть повні та скорочені йонні рівняння.
CuCl2 + ? → Cu(OH)2 + ?
Ba(NO3)2 + ? → BaSO4 + ?
FeS + ? → FeCl2 + ?↑
CaCl2 + ? → CaSO4 + ?
Na2CO3 + ? → CO2 + H2O + ?
NaOH + ? → ? + H2O
Домашнє завдання
Опрацювати параграф 12, вправа 148, 149, 153 стр.75
10.11
Тема: Реакції обміну між розчинами електролітів, умови їх перебігу
Основні поняття й терміни: розчини, електроліти, неелектроліти, розчинена речовина, електролітична дисоціація, йони, катіони, аніони, хімічний зв'язок, сильні і слабкі електроліти, ступінь дисоціації, реакція обміну, реакції йонного обміну, йонні рівняння, рН розчину.
Повторення
1.Згодні ви чи ні зі змістом твердження, відповісти «так» чи «ні» узазд (табл. 1).
Таблиця 1.
| Номер | Твердження | Відповідь |
| 1 | Електроліти – речовини, водні розчини або розплави яких проводять електричний струм |
|
| 2 | Неелектроліти – речовини, що в кристалічному стані не проводять електричний струм |
|
| 3 | ЕД називається процес розпаду речовини на молекули при розчиненні у воді |
|
| 4 | Основами називають електроліти, що розпадаються на катіони металів та на гідроксид-аніони |
|
| 5 | Спільні властивості кислот зумовлюють катіони кислотних залишків |
|
| 6 | Солі – електроліти, що дисоціюють на катіони металів та аніони кислотних залишків |
|
| 7 | Слабкі електроліти – це електроліти, що повністю дисоціюють на йони |
|
| 8 | Сильні електроліти мають ступінь ЕД більший 30 %. |
|
| 9 | До сильних електролітів належать належать усі добре розчинні солі, деякі кислоти та всі луги |
|
| 10 | До електролітів належать речовини з ковалентними неполярними зв’язками |
|
| 11 | Реакції обміну – це реакції, в які вступають дві складні речовини і вони обмінюються складовими частинами |
|
| 12 | Електроліти – це провідники першого роду |
|
Вивчення нового матеріалу
/uploads/editor/5002/403421/sitepage_177/files/999.pptx
Реакції обміну в розчинах електролітів називають реакціями йонного обміну.
Як проходять ці реакції з позиції теорії електролітичної дисоціації ми вивчимо за допомогою дослідів.
Взаємодія натрій гідроксиду із хлоридною кислотою
Вихідні речовини і один із продуктів – сильні електроліти. У водному розчині вони існують у вигляді йонів. Вода – слабкий електроліт і на йони практично не дисоціює. З огляду на це ми можемо записати рівняння даної реакції в такому вигляді:
Na+ + OH- + H+ + Cl- → Na+ + Cl- + H2O
Такий запис рівняння реакції називають йонним рівнянням або йонно-молекулярним, оскільки сильні електроліти записуються у йонному вигляді, а слабкі електроліти та неелектроліти в молекулярному вигляді. Із рівняння видно, що йони натрію та хлору не беруть участі в реакції, оскільки вони записані і в лівій, і в правій частинах рівняння, тому їх можна виключити, і одержимо рівняння: H+ + OH- → H2O.
Ми одержали скорочене йонне рівняння реакції нейтралізації. Воно показує суть даної реакції: в розчині присутні йони Гідрогену та гідроксид-іони, вони взаємодіють між собою і утворюють слабкий електроліт – воду.
Якщо під час реакції в розчині немає йонів, які можуть взаємодіяти (об’єднуватися) між собою, то реакція йонного обміну не відбувається. Наприклад, при зливанні розчинів калій хлориду і магній сульфату ніяких видимих змін не відбувається. Запишемо рівняння передбачуваної реакції:
2KCl + MgSO4 → MgCl2 + K2SO4
Всі її учасники є сильними електролітами:
2K+ + 2Cl- + Mg2+ + SO42- → Mg2+ + 2Cl- + 2K+ + SO42-
В цьому випадку ніякі йони один з одним не зв’язуються і змін у розчині не відбувається. Це означає, що реакція просто не протікає. Реакції між розчинами електролітів відбуваються, якщо продуктами є слабкі електроліти або неелектроліти. Це вода, осади та гази.
Отже, реакції йонного обміну між розчинами електролітів відбуваються, якщо виконується одна з умов:
А) випадає осад;
Б) виділяється газ;
В) утворюється вода.
З однією з трьох умов ми ознайомилися за допомогою демонстрації. Розглянемо дві інші умови.
Реакції, що відбуваються з утворенням осаду
BaCl2+ H2SO4 → BaSO4↓ + 2HCl
Обидві вихідні речовини і натрій хлорид є сильними електролітами, тому при розчиненні у воді вони розпадаються на йони. Барій сульфат нерозчинний у воді (неелектроліт):
Ba2+ + 2Cl- + 2H+ + SO42- → BaSO4↓ + 2H+ + 2Cl-
Скорочене йонне рівняння одержуємо з повного йонного, шляхом виключення однакових йонів із його лівої та правої частин:
Ba2+ + SO42- → BaSO4↓.
Отже, суть даної реакції полягає у взаємодії йонів Барію із сульфат-іонами з утворенням осаду барій сульфату. Внаслідок цього загальне число йонів у розчині зменшується. Якщо осад не утворюється, то реакція не відбувається.
Третя умова перебігу реакцій йонного обміну – виділення газу, що відбувається при взаємодії солей слабких кислот із сильними кислотами. Розглянемо реакцію взаємодії розчину натрій карбонату з розчином хлоридної кислоти:
Na2CO3 + 2HCl → 2NaCl + H2O + CO2↑
Повне йонне рівняння цієї реакції має такий вигляд:
2Na+ + CO32- + 2H+ + 2Cl- → 2Na+ + 2Cl- + H2O + CO2↑
Скорочене йонне рівняння одержуємо з повного йонного, шляхом виключення однакових йонів із його лівої та правої частин:
2H+ + CO32- → H2O + CO2↑.
Скорочене йонне рівняння показує, що йони Гідрогену зв’язуються з карбонат-іонами, з утворенням вуглекислого газу та води.
Узагальнення
Записати продукти реакції, врівняти рівняння, записати повні та скорочені йонні рівняння:
А) Барій хлорид + натрій сульфат →
Б) Натрій карбонат + сульфатна кислота →
В) Калій гідроксид + хлоридна кислота →
Г) Кальцій хлорид + натрій карбонат →
Домашнє завдання
Вивчити відповідний §, конспект.
Записати йонні рівняння реакцій між речовинами:
А) цинк хлорид + калій гідроксид →
Б) натрій гідроксид + сульфатна кислота →
В) магній + хлоридна кислота →
Г) кальцій карбонат + сульфатна кислота →.
05.11
Тема уроку. Поняття про рН розчину .Значення рН для характеристики кислотного чи лужного середовища.
Ми знаємо ,що вода це слабкий електроліт. У чистій воді й у будь-якому розчині разом із частинками розчинених речовин наявні також йони H+ та OH-. Це відбувається завдяки дисоціації самої води. І хоча ми вважаємо воду неелектролітом, тим не менш вона може дисоціювати: H2O <=> H+ + OH-. Але цей процес відбувається дуже незначною мірою: в 1 л води на йони дисоціює лише 1 • 10-7 моль молекул. Часто буває недостатньо сказати, що середовище кислотне чи лужне, а необхідно кількісно його схарактеризувати.
Кислотність середовища кількісно характеризують водневим показником pH (вимовляється «пе-аш»), що пов’язаний з концентрацією йонів Гідрогену. . Значення pH відповідає певному вмісту катіонів Гідрогену в 1 л розчину. У чистій воді й у нейтральних розчинах у 1 л міститься 1 • 107 моль йонів H+, а значення pH дорівнює 7. У розчинах кислот вміст катіонів H+ більше, ніж у чистій воді, а в лужних розчинах — менше. Відповідно до цього змінюється й значення водневого показника pH: у кислотному середовищі він перебуває в межах від 0 до 7, а в лужних — від 7 до 14.
Уявімо собі, що ми науковці і присутні на засіданні вченої ради, де будуть розглядатися важливі питання пов’язані з водневим показником. Дозвольте мені очолити засідання вченої ради. По першому питанню порядку денного нашого засідання слово надається представнику кафедри історії.
1.Уперше водневий показник запропонував використовувати датський хімік Петер Сьоренсен..
Датський фізико-хімік і біохімік, президент Датського королівського товариства. Закінчив Копенгагенський університет. У 31 рік став професором Датського політехнічного інституту в Копенгагені. За сумісництвом очолював престижну фізико-хімічну лабораторію при пивоварному заводі Карлсберга в Копенгагені, де зробив свої головні наукові відкриття. Основна наукова діяльність була присвячена теорії розчинів: він ввів поняття про водневий показник (рН), вивчав залежність активності ферментів від кислотності розчинів. За свої наукові досягнення Сьоренсен внесений до переліку «100 видатних хіміків XX століття», але в історії науки він залишився насамперед як учений, що ввів у науку поняття «рН» та «рН-метрії».
2. Визначення кислотності середовища.
Для визначення кислотності розчину в лабораторіях найчастіше використовують універсальний індикатор За його забарвленням можна визначити не тільки наявність кислоти чи лугу, але й значення рH розчину з точністю до 0,5.
Для точнішого вимірювання рH існують спеціальні прилади — рН-метри. Вони дозволяють визначити рH розчину з точністю до 0,001-0,01.
Кислотно-лужна рівновага :основні хімічні процеси в організмі людини.
Я хочу розповісти ,як впливає значення рН на процеси, які проходять в нашому організмі, адже там відбуваються чисельні хімічні реакції.
Тіло людини на 70% складається з води, тому вода - це одна з найбільш важливих його складових .Внутрішні рідини мають певне кислотно-лужне співвідношення, що характеризується рН показником .У клінічній діагностиці визначають pH плазми крові, сечі, шлункового соку ,слини тощо .Прошу відкрити підручник на сторінці 65 малюнок 11.6 на якому ви побачите значення біологічних рідин організму людини.
Дуже важливо вчасно звернути увагу на зміну рівня рН внутрішнього середовища організму і за необхідності вжити невідкладних заходів. Найпростіше контролювати рівень рН організму можна, вимірюючи рН сечі й слини. Якщо рівень рН сечі коливається в межах 6,0 - 6,4 вранці і 6,4 - 7,0 ввечері, то ваш організм функціонує нормально. Лужність сечі збільшується при вживанні мінеральних вод, при блювоті і проносі, хронічній інфекції сечовивідних шляхів, при циститах та запальних захворюваннях сечового міхура Кислотність збільшується при цукровому діабеті, туберкульозі нирок і сечового міхура, нирковій недостатності, при гарячці, голодуванні, нирково-кам’яній хворобі, гіпокаліємії та гіпохлоремії, вливанні великої кількості ізотонічного розчину натрію хлориду, у дітей при діатезі.
Якщо в слині відмітка рівня рН залишається між 6,4 - 6,8 в протягом усього дня - це також свідчить про здоров'я вашого організму.
Ми побувала в лабораторії Скалатської лікарні. Де нам розповіли і продемонстрували як визначають р Н сечі і для чого це роблять, також ми дізналися , що в аптеці можна придбати р Н –тест і самостійно визначати , при потребі , рН сечі, слюни, а також грунту і харчових продуктів. Представляємо розгортку з світлинами .
рН крові одна з найжорсткіших фізіологічних констант організму. У нормі цей показник може змінюватися в межах 7,3 б - 7,42.
Зрушення цього показника хоча б на 0,1 може привести до важкої патології.
При зсуві рН крові на 0,2 розвивається коматозний стан, на 0,3 - людина гине.
Дисбаланс рН організму у більшості людей проявляється у вигляді підвищеної кислотності (стан ацидозу). При ацидозі можуть з'явитися наступні проблеми:
- Захворювання серцево-судинної системи
- Збільшення ваги та діабет.
- Захворювання нирок і сечового міхура, утворення каменів.
- Зниження імунітету.
- Крихкість кісток
- Загальна слабкість.
При підвищеному вмісті лугу в організмі, а цей стан називається алкалоз, також як при ацидозі, порушується засвоєння мінералів. Їжа засвоюється набагато повільніше, що дозволяє токсинам проникати з шлунково-кишкового тракту в кров.
Підвищений вміст лугу може спровокувати:
- Проблеми з шкірою і печінкою.
- Сильний і неприємний запах з рота і тіла.
- Активізацію життєдіяльності паразитів.
- Різноманітні алергічні прояви.
Якщо людина вживає занадто багато тваринного жиру, кави, алкоголю і солодкого, то в організмі відбувається "переокислення", а значить, переважання кислотного середовища над лужний. Куріння і постійні стреси теж негативно впливають на pH крові. Для поновлення кислотно-лужного балансу потрібні оздоровчі та очищаючі процедури і корисне збалансоване харчування.
Дослідження впливу кислотності і лужності грунтів на розвиток рослин Наша група поставила собі за мету «Дізнатися здоров'я нашої землі.» Провівши численні дослідження, я з'ясував, що для нормального розвитку с/г культур і одержання високих урожаїв необхідна певна реакція ґрунтового розчину, від якої залежать мікробіологічні процеси, розвиток рослин і напрям процесів грунтоутворення. Реакція ґрунтового розчину в свою чергу залежить від наявності в ґрунтовому розчині йонів Гідрогену, які зумовлюють кислу реакцію та гідроксид- іонів, що створюють лужну реакцію .Бувають також ґрунти з нейтральною реакцією .
Рослини, які ростуть у великій кількості на грунті можуть вказати їх певну реакцію. (на дошці магнітами прикріплює зображення рослин).Але не слід покладатися виключно на рослини. Кислотність грунту визначає кількість вапна в землі. Коли вапна дуже мало - грунт стає кислим .
Ось один із способів для визначення кислотності грунту в домашніх умовах:
(учень демонструє дослід і коментує)
жменьку землі облити дуже розведеною хлоридною кислотою або просто оцтом, який знаходиться в кожному будинку. Якщо облита земля «скипить» і на ній з'являться маленькі бульбашки - грунт нормальної кислотності, вапна достатньо. Якщо земля на оцтові процедури ніяк не реагує, значить грунт надто кислий, необхідне вапно. Звичайно, цей спосіб лише приблизно покаже про стан вашого грунту, підкаже, чи потрібні якісь дії для поліпшення грунту. Не забувайте, реакція грунту з кожним роком змінюється. Змінюється під впливом рослин того чи іншого виду, застосовуваних добрив, навіть обробітку. Більшість рослин не переносять кислого грунту, тому необхідно визначити її кислотність і виявивши занадто високий pH грунт нейтралізувати, щоб рослини могли далі рости і нормально розвиватися.
Для усунення кислотності грунту застосовується вапнування грунтів –внесення в них вапняків. Якщо грунти з підвищеною лужністю, то для її усунення застосовують гіпсування.
Вашій увазі карта нашого міста Скалат за допомогою якої можна визначити типи грунтів за значенням водневого показника. Цю карту ми склали на основі досліджень р H грунтів різних мікрорайонів нашого міста. Спочатку ми взяли зразки грунтів. В хімічній лабораторії визначили р H середовища грунтів за допомогою універсального індикатора і р H-метра.
Тож дана карта допоможе кожному із нас визначити тип грунту і його кислотність.
Захист наукових робіт продовжить представник кафедри основ здоров'я.Тема наукової роботи «Дослідження середовища продуктів харчування»
Я досліджувала вплив продуктів харчування на здоров'я людини зокрема «Кока-Коли».
Для цього у три хімічні стакани наливаємо воду і в три інші –наливаємо напій «Кока-Коли». (відео)
У перший стакан з напоєм і водою кладемо яєчну шкарлупу, у другий стакан з напоєм і водою кладемо курячу печінку ,а в третій-наливаємо молоко. Через три дні : у стаканах з водою змін не відбулося, а в стаканчиках з напоєм –яєчна шкарлупа стала м'ягша, печінка змінила зовнішній вигляд ,молоко ,яке містить білок, теж змінилося. А тепер визначимо рН середовища води і напою. Вода- нейтральне, напій-кисле.
. Висновок, до якого я прийшла, був наступним – в «Кока-Колі» міститься ортофосфатна кислота, яка завдає шкоди кісткам, вона вимиває з них солі кальцію. Такий процес призводить до збільшення солей кальцію в крові, які в подальшому формують в нирках кристали і поступово утворюють каміння .
Найперші реакції організму на Кока-Колу викликані надходженням цукру, адже дев`ять чайних ложок цукру (це щоденна рекомендована норма) потрапляють в шлунково-кишковий тракт, примушуючи підшлункову залозу викинути в кров значну порцію інсуліну. Крім того, тривале вживання такого насиченого розчину може прискорити перебіг карієсу, створюючи сприятливі умови для розмноження мікроорганізмів.
Регулярне вживання Кока-Коли може стати причиною ураження м’язових тканин, оскільки вживання «шипучки» в обсязі кілька літрів на день приводили до виникнення почуття втоми, втрати апетиту та до блокади провідності в серці. Постійне споживання газованих безалкогольних напоїв збільшує ризик захворювання на рак підшлункової залози майже в 2 рази. У зв’язку з цим різноманітні лимонади і всілякі « Коли» не рекомендується регулярно вживати ні дітям, ні дорослим, особливо вагітним і годуючим жінкам. Здорова доросла людина може інколи спожити чудо-напій, але захоплюватися ним не варто. .
Домашнє завдання.
Вивчити § 11 «Кислотність середовища.Поняття про рн розчину.»
Конспект. Вправа 139 стр. 67
03.11. 2020
Ступінь електролітичної дисоціації. Сильні і слабкі електроліти.
І. Актуалізація опорних знань
- Хімічний диктант ( в зошит)
1. Який йон обов’язково утворюють в розчинах кислоти?
2. Який йон обов’язковоутворюють в розчинахоснови?
3. Якийколірмає лакмус в розчинах кислот?
4. Якийколірмає лакмус в розчинахлугів?
5.Як змінюєзабарвлення метилоранжу гідроген – йон (Н+) ?
6.Як змінює забарвлення метилоранжу гідроксид – йон (ОН─) ?
7. Якогокольорунабуваєфенолфталеїн в розчинахлугів?
8.Який аніонутворюєхлоридна кислота?
9.Який катіонутворює цинк хлорид?
10. Напишіть рівняння дисоціації ферум (ІІІ) сульфату.
Вивчення нового матеріалу.
Кількісно процес дисоціації речовин у розчині оцінюють ступенем дисоціації.
Ступінь дисоціації - це відношення числа частинок, що розщепилися на йони (n), до загального числа частинок (N) розчиненої речовини.
n n
![]()
![]() α = ; n = α ∙ N; N =
α = ; n = α ∙ N; N =
N α
α - ступінь дисоціації
n- кількістьдисоційованих частинок (молекул)
N- загальне число частинок (молекул)
α = 0 – дисоціація не відбувається
α = 1, або 100% - на йони розпадаються всі молекули
α = 0,3, або 30% - із 100 молекул на йони розпалися 30.
Задача №1
Обчислитиступіньдисоціаціїелектроліту, якщоіз 150 молекул на йонирозпалося 90.
![]() Дано: n
Дано: n
![]() N = 150 α =
N = 150 α =
n = 90 N
![]() 90
90
![]() α - ? α = = 0,6 або 60%
α - ? α = = 0,6 або 60%
150
Відповідь: α = 60%
Задача №2
Обчислити, скільки молекул продисоційовало із 120 взятих молекул. Якщо ступінь дисоціації електроліту становить 95%.
![]() Дано: n = α ∙ N
Дано: n = α ∙ N
N = 120 n = 120∙ 0,95 = 114
α = 95%
![]() Відповідь: n = 114
Відповідь: n = 114
n - ?
Залежно від ступеня дисоціації електроліти поділяються на три групи:
![]() Електроліти
Електроліти
| Сильні α >30%
| Середньої сили 30% > α > 2%
H3PO4, H2SO3, HF | Слабкі α< 2%
|
Закріплення і узагальнення набутих знань
- Що називається ступенем дисоціації?
- Як позначаєтьсяступінь дисоціації?
- В чому вимірюється ступіньдисоціації?
- На які групи поділяються електроліти за значенням ступеня дисоціації?
Задача 3.Скільки частинокміститься в розчиніхлоридноїкислоти, якщобуло взято всього 100 молекул HCl, а ступіньдисоціації становить 78%.
![]() Дано: n = α ∙ N
Дано: n = α ∙ N
N = 100 n = 100∙ 0,78 = 78
α = 78%
![]() 78 х у
78 х у
ск. всього НСl ↔ Н+ + Сl-
частинок - ? 1 1 1
n(Н+): х = 78∙1/1 = 78 n(Cl-): у = 78∙1/1 = 78 n(НCl)що не про дисоціювали = 100- 78 = 22
Загальне число частинок:
n(Н+) + n(Cl-)+ n(НCl)що не про дисоціювали = 78 +78 + 22 = 178 частинок
Відповідь:178 частинок
Задача 4. Скільки частинок міститься в розчині сульфатної кислоти, якщо було взято всього 100 молекул H2SO4, а ступінь дисоціації становить 80%.
![]() Дано: n = α ∙ N
Дано: n = α ∙ N
N = 100 n = 100∙ 0,80 = 80
α = 80%
![]() 80 х у
80 х у
ск. всього H2SO4 ↔2 H+ + SO42-
частинок - ? 1 2 1
n(Н+): х =80∙2/1 = 160
n(SO42-): у = 80∙1/1 = 80
n(H2SO4)що не про дисоціювали = 100- 80 = 20
Загальне число частинок:
n(Н+) + n(SO42-)+ n(H2SO4)що не про дисоціювали = 160 +80 + 20 = 260 частинок
Відповідь:260 частинок
Задача 5. Розчинмістить 0,2 моль йонівAl3+. Обчислітьмасуйонівалюмінію, якімістяться в розчині.
![]() Дано: m
Дано: m
![]() υ (Al3+) = 0,2 моль υ = ; m = υ ∙ M
υ (Al3+) = 0,2 моль υ = ; m = υ ∙ M
![]() M
M
m (Al3+) - ?
m (Al3+) = 0,2 ∙ 27 = 5,4 г
Відповідь: m (Al3+) = 5,4г
Домашнє завдання:
Опрацювати парагаф 10 , вправа 123, 124, конспект.
Якщо виникають запитання, будь ласка, звертайтеся, контактний номер телефону: 0992396461 або електронна пошта:
rogulicvalentina@gmail.com
21.05
Значення хімії в житті суспільства. Роль хімії для забезпечення сталого розвитку
Опрацьовуємо параграф 40.
18.05
Підсумкова контрольна робота за ІІ семестр
1.Денатурація білків – це руйнування структури:
а) первинної; б) вторинної;
в) вторинної та третинної; г) четвертинної.
2.Укажіть спільну ознаку для жирів:
а) надзвичайно низька температура кипіння;
б) взаємодія з натрієм;
в) нерозчинність у воді;
г) приємний запах.
3. Укажіть ознаку, характерну для глюкози:
а) за звичайних умов легко реагує з натрій гідроксидом;
б) має молекулярну кристалічну гратку;
в) за звичайних умов рідина;
4. Укажіть групу, до яких належить глюкоза:
а) моносахариди; в) трисахариди;
б) дисахариди; г) полісахариди.
5. Укажіть, до якого класу сполук належать білки:
а) Оксиди; в) Вуглеводні;
б) Полімери; г) Метали.
6. Позначте гомологічну різницю:
а) СН2; б) СН;
в) СН4; г) СН3;
7. Первинна структура білка…
8. Напишіть у молекулярній та іонній формах реакції взаємодії між речовинами:
а) оцтовою кислотою й кальцієм;
б) оцтовою кислотою й натрій гідроксид.
9. Загальна формула жирів:
10. У медицині для ін'єкцій використовують розчин глюкози з масовою часткою близько 5%. Обчисліть масу глюкози, необхідну для приготування такого розчину масою 1 кг.
14.05
Захист довкілля від стійких органічних забруднювачів
Ви вже ознайомилися з багатьма органічними речовинами: вуглеводнями, етанолом, гліцеролом, етановою кислотою, жирами, вуглеводами та білками. Усі ці органічні сполуки є природними, оскільки вони трапляються у природі. Також вам уже відома речовина, що належить до органічних полімерів, - поліетилен. Поліетилен не трапляється у природі. Жодний живий організм не може його синтезувати, тому такі речовини називають синтетичними.
Природні органічні речовини див. ст. 225
Синтетичні органічні речовини див. ст. 226-227
Захист довкілля від стійких органічних забруднювачів - опрацьовуємо ст. 228-229.
Домашнє завдання: опрацювати параграф 39.
07.05
Практична робота №5. Виявлення органічних сполук у харчових продуктах.
Виконуємо практичну роботу на ст. 216-218
04.05
Білки як біологічні полімери. Денатурація білків. Біологічна роль амінокислот і білків
Білки - природні високомолекулярні сполуки, молекули яких складаються із залишків молекул амінокислот, які сполученні один з одним пептидним зв'язком.
Будова білків опрацьовуємо ст. 219-220.
Руйнування просторової структкри білка зі збереженням його первинної структури називають денатурацією.
Біологічна роль амінокислот і білків ст. 222.
Домашнє завдання: опрацювати параграф 38
30.04
Поняття про амінокислоти
Пригадайте з курсу біології про амінокислоти.
Амінокислоти - органічні кислоти в молекулах якиє є карбоксильна група -СООН та аміногрупа -NH2. У природі переважають амінокислоти у яких обидві групи сполучені з одним атомом карбону.
Найпростіша амінокислота - аміноетанова (див. ст. 218).
Амінокислоти - тверді безбарвні кристалічні речовини, добре розчинні у воді й погано - в органічних розчинниках.
Домашнє заввдання: опрацювати параграф 38
27.04
Застосування вуглеводів, їхня біологічна роль.
Опрацьовуємо параграф 36,37.
23.04
Крохмаль і целюлоза - природні полімери. Якісні реакції на глюкозу і крохмаль.
Домашнє завдання: повторити параграф 36, 37.
16.04
Вугеводи: глюкоза, сахароза, крохмаль, целюлоза. Молекулярні формули, фізичні властивості, поширення і утворення у природі.
Вуглеводи - органічні сполуки із загальною формулою Сn(H2O)m m, n більше 3.
Класифікація вуглеводів (схема 6) див. ст. 203.
Опрацьовуємо матеріал параграфу 36 та 37.
Виконуємо №446
1) С6Н12О6 +6О2 = 6СО2 + 6Н2О
2) Са(ОН)2 + СО2 = СаСО3 + Н2О
№452

№ 461
Mr( C6H10O5) = 6*12 + 10*1 + 5*16 = 72+ 10+ 80 = 162
2100000 : 162 = 12963
Відповідь: n=12963
Домашнє завдання: опрацювати параграф 36,37.
13.04
Жири. Склад жирів, фізичні властивості, класифікація. Біологічна роль жирів.
Жири - це клас органічних сполук, молекули яких складаються із залишків молекли багатоатомного спирту гліцеролу та вищих карбонових кислот.
Загальна формула жирів див. ст. 197
Фізичні властивості та класифікація жирів, біологічна роль жирів опрацьовуємо матеріал параграфа на ст. 197-201.
Домашнє завдання: опрацювати параграф 35.
09.04
Контроль знань
1.Позначте загальну формулу насичених одноосновних карбонових кислот:
а) СпН2пСООН
б) СпН2п+1СООН
в) СпН2п+2СООН
г) СпН2п-1СООН
2. Позначте, який зі спиртів виявляє надзвичайну токсичність:
а) етиловий;
б) пропиловий;
в) метиловий;
г) пентиловий.
3. Укажіть властивості етанолу, що спричиняють його застосування у фармацевтичній промисловості:
а) чудовий розчинник і антисептик;
б) має слабку наркотичну дію;
в) добре розчиняється у воді;
4. Установіть відповідність.
1. СН3-СООН A. Пентанол
2. СН3-СН2-СН2-ОН Б. Етанова кислота
3. СН3-СН2- СН2-СООН B. Бутанова кислота
4. СН3-СН2 СН2-CН2- СН2ОН Г. Пропанол
5. Напишіть у молекулярній та іонній формах реакції взаємодії між речовинами:
а) оцтовою кислотою й магнієм;
б) оцтовою кислотою й калій гідроксидом.
6. Напишіть формулу карбонової кислоти, молекулярна маса якої дорівнює 102.
7. Обчисліть масу етанолу, для згорання якого вистачить кисню обємом 6, 72 л (н.у.).
06.04
Вищі карбонові кислоти: стеаринова, пальмітинова, олеїнова. Мило.
Вищими карбоновими кислотами (скорочено ВКК) називають карбонові кислоти, у молекулах яких міститься від 12 до 22 атомів Карбону. Як і вуглеводні, вищі карбонові кислоти можуть бути насиченими та ненасиченими.
З насичених ВКК найчастіше трапляються стеаринова С17Н35СООН й пальмітинова кислоти С15Н31СООН. (див. ст. 190)
Ненасичені – олеїнова С17Н33СООН та інші (див. ст. 190)
Солі ВКК використовують у виготовленні мила. Звичайне господарське мило на 72% складається із солей ВКК.
Мийна дія мила (опрацьовуємо у підручнику ст.192-193.
Виконуємо №419
2С17Н35СООК + СаСІ2 → (С17Н35СОО)2Са + 2НСІ
№415
До одноосновних, оскільки містять по одній карбоксильній групі СООН.
Домашнє завдання: опрацювати §34
02.04
Практична робота №4. Властивості етанової кислоти.
Повторюємо правила безпеки на ст. 189
Виконуємо дослід 1,2 ст 189
Робимо висновок до практичної роботи.
30.03
Хімічні властивості етанової кислоти.
Етанова кислота виявляє усі відомі вам загальні властивості слабких кислот: реагує з акивними металами, основними оксидами, лугами й солями слабкіших кислот (рівняння реакцій див. на ст. 185).
Виконуємо № 398
| HCI | CH3COOH |
| HCI + KOH = KCI + H2O | CH3COOH + KOH = CH3COOK +H2O |
| 2HCI + Mg = MgCI2 + H2 | 2CH3COOH + Mg = (CH3COO)2Mg + H2 |
| 2HCI + FeO = FeCI2 + H2O | CH3COOH + FeO = (CH3COO)2Fe + H2O |
| 2HCI + CaCO3 = CaCI2 +CO2 + H2O | 2CH3COOH + CaCO3 = (CH3COO)2Ca +CO2 + H2O |
Домашнє завдання: опрацювати параграф 33.
Етанова (оцтова) кислота, її молекулярна і структурні формули, фізичні властивості.
Хіба ми можемо уявити життя без цієї речовини? Без маринованих огірочків, грибів? Всі ми знаємо запах цієї речовини і не зплутаємо його ні з якою іншою речовиною. Як ви думаєте з якою речовиною будемо ознайомлюватися сьогодні?
Більшість органічних кислот становлять склад карбонових кислот.
Карбоновими кислотами називають похідні вуглеводнів, у молекулах яких міститься карбоксильна група – СООН.
Див. ст 184 структурну формулу етанової кислоти. Молекулярна формула – СН3-СООН.
Так, як кислота має два атоми Карбону, називається етанова. Кислота, яка має один атом Карбону – метанова (НСООН).
Більшість карбонових кислот мають традиційні назви. Наприклад, назва етанової кислоти – оцтова, метанової – мурашина.
Фізичні властивості див. ст 184.
Виконуємо №401
Дано: Розв’язання
V(розчину)=750мл Густина розчину дорівнює густині води.
W1(кислоти)= 6% 750 мл = 750 г
![]() W2(кислоти)=70% W1(кислоти) = m(кислоти)· m(розчину)
W2(кислоти)=70% W1(кислоти) = m(кислоти)· m(розчину)
m( есенції) - ? m(кислоти) = m(розчину)· W1(кислоти)
V(води)- ? Підставляємо
m(кислоти) = 750г · 0.06 = 45г
Обчислюємо m (есенції)
m(есенції) = m(кислоти) : W2(кислоти) = 45г : 0.7 = 64.3 г
Обчислюємо масу води
m(води) = m(розчину) - m(есенції) = 750 г – 64.3 г = 685,7 г
Відповідь: m(есенції) = 64.3 г, V(води) = 685,7 мл
Домашнє завдання: опрацювати §33
Отруйність спиртів, їх згубна дія на організм людини. Застосування метанолу та етанолу.
Тестовий контроль. Самоконтроль ( максимальна оцінка 7 балів)
1. Функціональна група спиртів – це:
а) група атомів СООН б) група атомів ОН
в) група атомів СОН г) група атомів NО2
2. Біологічні властивості етанолу:
а) нетоксичний, б) наркотична речовина,
в) сильна отрута, г) снодійне.
3. Укажіть, які фізичні властивості характерні для етанолу:
а) в’язка рідина, б) добре розчиняється уводі.
в) має солодкий смак, г) має специфічний запах.
4. Атоми яких хімічних елементів обов’язково присутні в усіх молекулах спиртів:
а) С, N, Н, б) С, О, Н, в) С, Н, Сl
5. Зі збільшенням вуглеводневого радикала розчинність спиртів у воді:
а) збільшується, б) зменшується, в) не змінюється, г) спочатку збільшується, а потім зменшується.
6. Найбільшу розчинність у воді має:
а) метанол, б) бензин, в) пропанол, г) бутанол.
7. Укажіть молекулярну формулу етанолу:
а) С3Н7ОН, б) С2Н5ОН, в) С2Н5СОН, г) СН3ОН.
Вивчення нового матеріалу
1. Історичні відомості про алкоголь та його виробництво
Чистий спирт почали одержувати в VІ столітті араби, які називали його «аль коголь», що означає «одурманюючий». Першу пляшку горілки виготовили араби до 860 р. Перегонка вина з метою одержання спирту різко збільшила кількість п’яниць. Не виключено, що саме це й стало приводом до заборони вживання спиртних напоїв, до якої вдався основоположник ісламу Магомет. Відтоді в мусульманських країнах алкоголю не вживали. А відступників від цього закону жорстоко карали.
За часів Середньовіччя у Західній Європі також навчилися одержувати міцні напої, переганяючи вино та інші цукристі рідини, які мають здатність бродити. За легендою, алхімік Валеніус, який одержав спирт, заявив, що він знайшов чудесний еліксир, який старого робить молодим, стомленого – бадьорим, зажуреного – веселим. Злу силу алкоголю розуміло багато людей. Відомий релігійний реформатор Мартін Лютер писав: «Кожна країна повинна мати свого диявола: наш німецький диявол – добра бочка вина». Поширення пияцтва на Русі пов’язане з політикою панівних класів. Виникла навіть думка, що пияцтво є нібито стародавньою народною традицією. При цьому посилалися на слова літопису «Веселість на Русі». Але це наклеп на нашу історію. Відомий історик Костомаров повністю спростував цю думку. Він довів, що в Стародавній Русі пили мало. Лише на великі свята варили мед, брагу, пиво, міцність яких не перевищувала 5 – 10 градусів. У будні жодних спиртних напоїв не вживали, й пияцтво вважалося великим гріхом, ганьбою. Життя показало, що заборона продажу спиртних напоїв у деяких країнах не тільки не сприяє зменшенню алкоголізму, але й у деяких випадках – збільшенню пияцтва.
Боротьба з алкоголізмом має таку ж давню історію, як і самі спиртні напої. У Стародавній Греції пити нерозведене водою вино ( міцність його не перевищувала 10 градусів_ вважалося недостойним вільного громадянина. Правитель Спарти заборонив пити вино вищій знаті держави, але заохочував споювання рабів, щоб тримати їх у покорі.
В Афінах правитель Соломон запровадив сухий закон, за яким службових осіб карали за пияцтво: вперше великим штрафом, а в разі повторення – стратою.
Давньоримський історик Пліній Старший писав про те, що перси та мідяни були переможені греками під керівництвом О. Македонського тому, що в них були розвинуті пияцтво та інші пов’язані з ним пороки.
2. Згубна дія алкоголю на організм людини.
Дослід: в пробірках міститься яєчний білок та шматок хліба, додаємо в пробірки, окремо, воду і розчин спирту. Спостерігаємо, що яєчний білок у воді розчиняється, а в спирті – згортається, шматок хліба у воді м’якшає і плаває на поверхні, а в спирті – твердне. Отже, спирт ослаблює й руйнує живі клітини. Саме на цій здатності спирту засноване його застосування в медицині як дезінфікуючого засобу.
Під час уживання алкоголь зі шлунка й кишечнику всмоктується в кров. Розподіляється із кров’ю по всьому організмові, він з руйнівною силою впливає на всі органи й системи людини. Особливо шкідливий він для нервових клітин, що зумовлюється легкою розчинністю алкоголю в жирових і жироподібних речовинах, які становлять основу нервової тканини. Проникаючи в нервову клітину, алкоголь розчиняє життєво важливі для неї ліпоїдні речовини, змінюючи її нормальну діяльність. У результаті одного сильного сп’яніння гине до 20 тисяч клітин головного мозку: унаслідок уживання 100 грам пива – 3 тисячі клітин, 100 грам вина – 5 тисяч клітин. За роки в питущої людини гинуть мільйони клітин, які не відновлюються. Тому в людей, які зловживають спиртним, послаблюється пам’ять, увага, притупляються моральні якості. Не менш небезпечним є вживання алкоголю і для інших органів.
Уживання алкоголю натщесерце має сильніший і швидший ефект, ніж уживання під час або після їжі. Їжа діє як буфер під час поглинання спиту. В організмі спирт окислюється до вуглекислого газу і води. При цьому вивільняється велика кількість енергії – 29,8 кДж/год. А за 1 год в печінці окислюється близько 10 мл спирту. Уведення спирту в організм порушує його теплоізоляцію внаслідок розширення шкірних кровоносних судин. Суб’єктивне відчуття тепла, пов’язане з цим явищем, насправді не супроводжується підвищенням температури тіла. Навпаки, організм утрачає теплоту, тому вживання спирту на холоді пов’язане з ризиком замерзти.
З’ясовано, що вплив алкоголю під час внутрішньоутробного розвитку призводить до недорозвинення плоду або окремих його частин, підвищення смертності, розвитку нервово – психічних розладів, захворювання органів травлення, серцево – судинної системи.
Метанол дуже небезпечний для людини. 10-20 мл цієї речовини можуть викликати сліпоту і смерть. Причиною тому є дія ще більш сильної отрути – формальдегід, що утворюється в організмі при окисненні метанолу.
Встановлено, що третина ДТП трапляється з вини людей, які перебувають у стані сп’яніння. Через це гине 57, 7 % загальної кількості потерпілих. Навіть малі дози алкоголю ( 25 – 50 г) сповільнюють реакцію, 100 г підвищують ризик удвічі. Швидкість реакції сповільнюється на 0, 5 с. Так, якщо людина буде рухатися зі швидкістю 60 км/год, то вона встигне зреагувати на перешкоди не менш як за 10 м.
Алкоголізм не дає людині можливості мати міцну життєву позицію. Він веде до паразитичного способу життя, до постійного пошуку грошей, до злочинів. Установлено, що 55% крадіжок, 79 % пограбувань, 69 нападів здійснюється у стані сп’яніння.
3. Застосування метанолу й етанолу.
Спирти – важливий продукт, що застосовуються людиною. Використовуються як органічні розчинники, моторне паливо. Їх використовують для виробництва бутадієну, з якого згодом виготовляють синтетичний каучук. Зі спиртів одержують низку фармацевтичних препаратів, оцтову кислоту і фруктові есенції. Метиловий спирт використовують для одержання формальдегіду, необхідного для виробництва пластмас і фенол формальдегідних смол.
Закріплення знань.
- Чому етанол вважають небезпечною наркотичною речовиною?
- Чи усвідомили ви небезпеку вживання алкоголю?
Домашнє завдання
Опрацювати §31
Тема: Метанол, етанол, гліцерол: молекулярні і структурні формули, фізичні властивості. Горіння етанолу. Якісна реакція на гліцерол.
Спирти – це похідні вуглеводнів, у молекулах яких один або кілька атомів Гідрогену заміщені на гідроксильну групу –ОН.
Спирти, що містять одну групу –ОН, називають одноатомними, а ті, що містять дві або більше,- багатоатомними.
Ознайомлення з фізичними властивостями метанолу та етанолу ст. 172
Хімічні властивості спиртів: етанол горить на повітрі ледь помітним синім полум’ям, продуктами реакції є вуглекислий газ та вода.
С2Н5ОН +3О2 → 2СО2 + 3Н2О
Формула гліцеролу див. ст. 179
Ознайомлення з фізичними властивостями гліцеролу ст. 180
Хімічні властивості гліцеролу:
- Горіння
2С3Н8О3 + 7О2 → 6СО2 + 8Н2О
- Якісна реакція на гліцерол
2С3Н8О3+ Сu(ОН)2 → сполука темно-синього кольору.
Застосування гліцеролу ст. 181-182.
Завдання: опрацювати параграф 30,32, виконати завдання 385 ст. 183




