8 клас
Вчитель хімії: Янкович Оксана Олександрівна моб. 0955011502
Хімічні властивості кислот
Хімічні властивості кислот: дія на індикатори, взаємодія з металами, основними оксидами, основами, солями. Реакція нейтралізації. Ряд активності металів. Реакції заміщення й обміну. Заходи безпеки під час роботи з кислотами
Деякі з них, як-от хлоридна, сульфатна, нітратна, є токсичними й небезпечними для життя і функціонування живих організмів. Вони роз'їдають органічні речовини, спричиняють опіки.
Під час роботи з кислотами необхідно дотримуватися правил техніки безпеки!
| Хлоридна кислота | HCl | Хлоридна кислота це водний розчин гідроген хлориду. Прозора рідина, іцо на повітрі «димить». У концентрованому розчині цієї кислоти масова частка гідроген хлориду становить 36 40 %. Важча за воду. Має характерний різкий запах. Вдихання парів концентрованої хлоридної кислоти викликає подразнення й опіки дихальних шляхів. Під час роботи з хлоридною кислотою потрібно дотримуватися правил техніки безпеки. У лабораторії хлоридну кислоту добувають розчиненням гідроген хлориду у воді. Гідроген хлорид (хлороводень — традиційна назва) добувають шляхом взаємодії натрій хлориду (NaCI) з концентрованою сульфатною кислотою за нагрівання. |
| Сульфатна кислота | H2SO4 | Сульфатна кислота безбарвна рідина, нелетка, в’язка. Густина 1,84 г/см3. Під час розчинення у воді сильно розігрівається, аж до закипання розчину, що. V свою чергу, спричиняє його розбризгу-ваппя. Щоб уникнути цього, потрібно кислоту вливати у воду, а не навпаки. Характерною властивістю концентрованої сульфатної кислоти є здатність легко вбирати вологу (гігроскопічність). Цю властивість часто застосовують у промисловості для осушення газів. |
| Нітратна кислота | HNO3 | Нітратна кислота безбарвна рідина з різким, задушливим запахом, летка. Концентрована має жовте забарвлення, якого набуває за рахунок розчинення в ній нітроген(IV) оксиду. Масова частка кислоти в концентрованому розчині досягає 98 %. Руйнує білок. За потрапляння па шкіру спричиняє пожовтіння, опіки. |
| Ортофосфатна кислота | H3PO4 | Ортофосфатна кислота безбарвна, тверда, кристалічна речовина. Добре розчинна у воді, важча за воду. За темперетури вище 40 0C перетворюється па в’язку безбарвну рідину. На відміну від інших кислот не отруйна. |
1. Зміна забарвлення індикаторів.
Віртуальний лабораторний дослід 2. ДІЯ РОЗЧИНІВ КИСЛОТ НА ІНДИКАТОРИ
Досліджуємо, як діють кислоти па індикатори. Зверніть увагу, чи всі індикатори можна використовувати для виявлення кислот у розчинах.
Фенолфталеїн не змінює забарвлення в кислому середовищі. Усі інші індикатори (лакмус, метиловий оранжевий, універсальний індикаторний напір) набувають червоного забарвлення різних відтінків.
2. Взаємодія кислот з металами.
Спільною властивістю кислот є їх взаємодія з металами. Якщо до порошку магнію долити хлоридної кислоти, відбувається характерне «закипання» суміші через інтенсивне виділення газу водню, що витіснився магнієм з кислоти. Рівняння реакції:
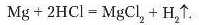
Аналогічно виділення водню спостерігається, якщо до гранул цинку долити розчину сульфатної кислоти (рис. 69):
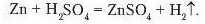
- Реакції заміщення — це реакції, що відбуваються між простою і складною речовинами, унаслідок чого атоми простої речовини заміщають атоми в складній.
Віртуальний лабораторний дослід З. ВЗАЄМОДІЯ ХЛОРИДНОЇ КИСЛОТИ З МЕТАЛАМИ
Досліджуємо, як взаємодіє хлоридна кислота з металами.
Це дослідження показує, що хімічна активність металів є неоднаковою. Одні метали проявляють більшу, інші меншу активність під час хімічних перетворень.
На основі експериментальних досліджень російський учений М. Бекетов розмістив метали у внтискувальиий ряд металів.
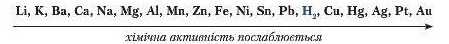
Виявлено, що метали, розташовані в ряді до водню, мають здатність витискувати його з кислот, утворюючи просту речовину водень (виняток нітратна кислота). П'ять металів, які розміщені після водню, з розчинами кислот не реагують. Кожний наступний метал у ряді є менш хімічно активний, ніж попередній. Самі ж метали заміщають атоми Гідрогену в кислоті. Такий тин реакцій називають реакціями заміщення.
Реакції заміщення це реакції, що відбуваються між простою та складною речовинами, унаслідок чого атоми простої речовини заміщають атоми в складній.
Окрім водню, під час реакції утворюється сіль відповідного металу.
3. Взаємодія кислот з основними оксидами.
Як приклади таких хімічних перетворень можна навести рівняння реакцій:
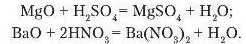
Реакції обміну - це реакції між двома складними речовинами, під час яких вони обмінюються складовими частинами.
4. Взаємодія кислот з основами
Кислоти взаємодіють з основами, при цьому утворюється сіль та вода.
Взаємодія кислот з оновами з утворенням солі та води називається реакцією нейтралізації.
Реакція нейтралізації належить до реакції обміну.
Приклади реакцій нейтралізації:
Са(OH)2 + 2HNO3 = Ca(NO3)2 + 2H2O
2Fe(OH)3 + 3H2SO4 = Fe2(SO4)2 +6H2O
5. Взаємодія кислот з солями
Кислотам властиво взаємодіяти з розчинами солей. Реакції між ними відбуваються за умови, якщо спостерігається:
а) випадання осаду;
б) виділення газу;
в) одним із продуктів реакції є вода.
CaCO3 + 2HCl = CaCl2 + H2O +CO2
Наприклад,
K2S + 2HCl = 2KCl + H2S
Na2SO3 + H2SO4 = Na2SO4 +H2O + SO2
ПІДСУМОВУЄМО ВИВЧEНE
- Кислоти за нормальних умов є рідинами або твердими речовинами. Важчі за воду, безбарвні. Добре розчиняються у воді. Водні розчини — кислі на смак, роз’їдають органічні речовини.
- Кислоти змінюють забарвлення індикаторів: лакмусу — на червоний, метилового оранжевого — на рожевий, універсальний індикаторний папір — на червоний.
- Кислоти (за винятком нітратної) взаємодіють з металами, що у витискувальному ряді розташовані до водню. Продуктами реакцій є сіль відповідного металу та водень.
- Реакції заміщення — це реакції, що відбуваються між простою і складною речовинами, унаслідок чого атоми простої речовини заміщають атоми в складній.
- Кислоти взаємодіють з оснбвними оксидами з утворенням солі та води.
- Реакції обміну — це реакції між двома складними речовинами, під час яких вони обмінюються складовими частинами.
- Кислоти взаємодіють з основами, в результаті реакції утворюється сіль та вода.
- Реакція нейтралізації - це взаємодія кислот з оновами з утворенням солі та води.
- Кислоти взаємодіють з солями за умови, якщо спостерігається: а) випадання осаду; б) виділення газу; в) одним із продуктів реакції є вода.
Домашнє завдання
Опрацювати поданий матеріал та параграф 28.
01.04, 05.04
Кислоти: склад і назви , класифікація, фізичні властивості. Поширеність у природі.
У формулах кислот на першому місці стоїть символ Гідрогену, а далі – атом або група атомів, що називається кислотним залишком.
Кислоти – складні речовини, що містять у своєму складі Гідроген та кислотний залишок.
Наприклад, у НСI кислотний залишок – СІ.
Валентність кислотних залишків дорівнює числу атомів Гідрогену в молекулі кислоти.
H2SO4 – валентність залишку SO4 дорівнює 2.
| Формула кислоти | Хімічна назва |
| HCI | Хлоридна |
| HBr | Бромідна |
| HI | Йодидна |
| HF | Флуоридна |
| HNO3 | Нітратна |
| HNO2
| Нітритна |
| H2S | Сульфідна |
| H2SO3 | Сульфітна |
| H2SO4 | Сульфатна |
| H2CO3 | Карбонатна |
| H2SiO3 | Силікатна |
| HPO3 | Метафосфатна |
| H3PO4 | Ортофосфатна |
Класифікація кислот:
А) за основністю (кількістю атомів Гідрогену) на одноосновні (HCI, HI, HNO3…), двохосновні (H2S, H2CO3), трьохосновні (H3PO4);
Б) за складом на оксигенвмісні, що містять Оксиген (H2SO4, H3PO4) та безоксигенові (HF, HCI).
Перегляньте прнзентацію та виконайте подані в ній завдання
Фізичні властивості кислот
Коли ми вивчали класифікацію кислот, звернули увагу, що більшість відомих кислот — це водні розчини. Без води їх властивості змінюються. Наприклад, безводна сульфатна кислота не взаємодіє із залізом, що дозволяє перевозити її в сталевих цистернах. А розчин цієї кислоти розчинить цистерну дорогою. Безводна хлоридна кислота — це газ гідрогенхлорид. А в разі розчинення у воді — це хлоридна кислота, що входить до складу шлункового соку.
Поширеність кислот у природі .
Мабуть, ви знаєте, що багато харчових продукт кислі на смак. Такого смаку їм надають органічні кислоти. Кислий смак лимона зумовлений наявністю лимонної кислоти, яблука - яблучної кислоти, кислого молока — молочної кислоти. Щавель має кислий смак, бо в його листі міститься щавлева кислота. Оцет є розчином оцтової кислоти.
Неорганічні кислоти, які ми вивчили, також трапляються у природі у вільному стані. Наприклад,
сульфіді (сірководнева) кислота Н2S є у вулканічних газах і у водах мінеральних джерел (Мацеста — Сочі на Чорноморському узбережжі Кавказу, в Україні — Немирів).
Хлоридна кислота НС1 входить до складу шлункового соку.
Карбонатна кислота Н2С03 — до складу природних мінеральних вод (Боржомі, Єсентуки, Нарзан на Кавказі, в Україні — Миргородська, Лужанська, Свалява, Трускавецька).
Нітратна НNОз і сульфітна Н2S03 кислоти трапляються в дощовій воді («кислоті дощі»).
Виконуємо завдання «Вилучи зайве»
- HCI, HNO3, К2SO4, H2S
Зайвим буде К2SO4 оскільки не є кислотою
- H2S, HI, HNO3, HBr
Зайвою є HNO3 оскільки вона є оксигенвмісною кислотою, а інші безоксигенові
- H3PO4, H2SO4, H2CO3, H2SiO3
Зайва H3PO4 , тому що вона трьохосновна, а решта двохосновні кислоти.
Домашнє завдання : опрацювати §28, вивчити формули та назви кислот.
29.03
Хімічні властивості амфотерних гідроксидів( Алюмінію, Цинку): взаємодія з кислотами, лугами ( в розчині при сплавлянні)
Перегляньте відео - урок
Амфоте́рність — здатність сполук проявляти кислотні й основні властивості. Амфотерними сполуками (їх ще називають амфолітами) є вода, гідроксиди алюмінію, цинку, хрому тощо.
-
Zn(OH)2 + H2SO4 = ZnSO4 + 2H2O
-
H2ZnO2 + 2NaOH = Na2ZnO2 + 2H2O
1) 2Zn + O2= 2ZnO
2) ZnO + 2HNO3 = Zn(NO3)2 + H2O
3) Zn(NO3)2+2 NaOH = Zn(OH)2 + 2NaNO3
4) Zn(OH)2 + 2NaOH = Na2ZnO2 + 2H2O
Домашнє завдання: опрацювати параграф 30.
25.03
Хімічні властивості нерозчинних основ: взаємодія з кислотами і розкладання внаслідок нагрівання.
Повторення
Здійсніть перетворення
Са - СаО -Са(ОН)2 -Са (NO3)2
Пригадаймо властивості онов, які ми розглядали на попередньому уроці. А саме, властивості нерозчинних основ.
Нерозчинні основи не діють на індикатори, реакції з кислотними оксидами для них не характерні, під час нагрівання розкладаються на відповідний оксид і воду, взаємодіють з кислотами, утворюючи сіль та воду.
Складаємо рівняння реакцій:
1) Mg(OH)2 = MgO + H2O
2) Ba(OH)2 + H2SO3 = BaSO3 + 2H2O
3) 2Fe(OH)3 = Fe2O3 + 3H2O
4) AI(OH)3 + 3HCI =AICI3 +3 H2O
. Обчисліть кількість речовини води, що утвориться внаслідок нагрівання ферум (ІІІ) гідроксиду масою 5,35г.
| Дано : m (Fe(OН)3 ) = 5,35г
|
| |
| Знайти : ν (Н2О) - ? | ||
| Розв’язання
0,05 моль t0C x моль 2Fe(OН)3 = Fe 2 O3 + 3 H 2O
Мr (Fe(OН)3)= 107 М (Fe(OН)3)= 107 г/моль m(Fe(OН)3 )= 107г | ||
| Обчислюємо кількість речовини Fe(OН)3 за формулою ν = m / М |
ν (Fe(OН)3 ) = 5,35 /107 = 0,05 моль
| |
| За рівнянням реакції складаємо співвідношення кількостей речовин і обчислюємо кількість речовини води | ν (Fe(OН)3 ) : ν (Н2О) = 2:3 0,05 моль : x моль = 2 моль : 3 моль x моль =0,05 • 3 / 2 x моль = 0,75 ν (Н2О) = 0,75 моль
| |
| Відповідь : ν (Н2О) = 0,75 моль
| ||
Домашнє завдання: знайти помилку у рівняннях реакції та виправити їх.
СаOH + HCI = CaCI2 + H2O
2Fe(OH)2 = Fe2O3 + 3H2O
Повторити параграф 26.
22.03
Хімічні властивості лугів: дія на індикатори , взаємодія з кислотами, кислотними оксидами, солями. Реакція нейтралізації . Заходи безпеки під час роботи з лугами.
Перегляньте відео-урок за посиланням:
Домашнє завдання
Опрацювати параграф 26. Впр. 5,6 стр. 105
18.03
Тема: Основи, їх склад і назви, класифікація, фізичні властивості. Поширеність у природі.
- Повторення.
Прийом «Вилучи зайве»
- СаО, МgO, CO2, Na2O
- SO2, CO2, NO2, K2O
- CO, BaO, Al2O3, HCI
- Вивчення нового матеріалу.
Переглянути презентацію та виконати подані завдання
Основами називають сполуки, що складаються з йона металічного елемента і гідроксогруп ОН.
Загальна формула гідроксиду Ме(ОН)n, де Ме – металічний елемент, ОН – гідроксильна група, n – валентність металу.
Число гідроксильних груп в основі визначається валентністю металічного елемента.
Назва основ складається з назви металічного елемента та слова гідроксид. Наприклад, NaOH – натрій гідроксид.
Якщо, валентність металу змінна , то вона вказується в дужках римською цифрою після назви металічного елемента. Наприклад, Fe(OH)2 - ферум(ІІ) гідроксид, Cu(OH)2 – купрум(ІІ) гідроксид.
Класифікація основ та фізичні властивості див. ст. 103-104.
Закріплення вивченого матеріалу.
Назвіть гідроксиди: КОН, Ва(ОН)2, СuOH, Mg(OH)2, Fe(OH)3
( калій гідроксид, барій гідроксид, купрум(І) гідроксид, магній гідроксид, ферум(ІІІ) гідроксид)
Домашнє завдання.
Опрацювати §27, виконати №6 ст. 107.
15.03
Обчислення за хімічними рівняннями кількості речовини, маси, об'ємів газів (н.у) за відомими кількістю речовини, масою, об'єму реагенту чи продукту реакції.
Переглянути відео за посиланням:
Домашнє звдання
Опрацювати параграф 25, виконати завдання 1,2, 5 стр 100.
25.02, 11.03
Тема. Фізичні та хімічні властивості основних, кислотних та амфотерних оксидів (взаємодія з водою, кислотами, лугами, іншими оксидами)
Повторення
- Дайте визначення оксидам. Класифікація оксидів.
- Назвати оксиди: CaO, CO2, N2O, CuO, Al2O3, SO3, Mn2O7, СO, SnO, Cl2O7, P2O5, K2O, BeO.
- Дописати рівняння реакцій:
Na2O +H2O =
CaO +H2O =
SiO2+H2O =
N2O5+H2O =
Вивчення нового матеріалу
Основні оксиди
Перегдянути відео
взаємодіють з кислотами з утворенням солі та води.
МgO + Н2SO4 = МgSO4 + Н2О
Відбулася реакція, у результаті якої атоми Магнію з магній (ІІ) оксиду та атоми Гідрогену з сульфатної кислоти обмінялися місцями. Такі реакції називаються реакціями обміну.
Реакції обміну – це реакції між двома складними речовинами, в процесі яких вони обмінюються своїми складовими,утворюючи дві нові складні речовини
2К2О + 2Н3РО4= 2К3РО4 + 3Н2О
Кислотні оксиди взаємодіють з основами з утворенням солі та води (кислотним залишком у солі буде залишок кислоти, яка відповідає кислотному оксиду).
2NaOH + СО2 = Nа2СО3 + Н2О
(оксиду СО2 відповідає кислота Н2СО3)
Основні оксиди і кислотні оксиди взаємодіють між собою з утворенням солі (кислотним залишком у солі буде залишок кислоти, яка відповідає кислотному оксиду).
Nа2О + SО3 = Nа2SО4 (оксиду SО3 відповідає кислота Н2SO4)
СаО + SО2 = СаSО3 (оксиду SО2 відповідає кислота Н2SO3)
Амфотерні оксиди - це складна хімічна речовина, такі оксиди, які утворюють сіль з хімічними реакціями з кислотами (або оксидами кислот) і з основами (або основними оксидами).
Переглянути відео
Прикладом амфотерних оксидів може бути:
ZnO – Цинк оксид, Al2O3 – Алюміній оксид.
Хімічні властивості амфотерних оксидів унікальні тим, що вони можуть вступати в хімічну реакцію з основами та кислотами.
Наприклад:
1.Реакція з кислотою:
ZnO + H2CO3 → ZnCO3 + H2O
2.Реакція з основами:
ZnO + 2NaOH → Na2ZnO2 + H2O
Виконати наступні завдання
1. Дописати рівняння реакцій:
ZnO +H2SO4 =
MgO + HCl =
ZnO +SO3 =
MgO + CO2=
2. Запишіть пропущені в рівняннях формули, розставте коефіцієнти:
а) Na2O +... = NaOH
б) ... + H2O = HNO3
в) MgO +... = Mg3(PO4)2 +...
г) Ba (OH)2 +... = BaCO3 + H2O
д) ... + SO3 = CaSO4
Домашнє завдання
Опрацювати параграф 24 , виконати вправи 1, 2, 3 ст 95 . записати в зошит короткий конспект.
ЦІКАВІ ФАКТИ ПРО ОКСИДИ: ЗНАХОДЖЕННЯ В ПРИРОДІ, ЗАСТОСУВАННЯ
22.02
Тема: Оксиди , їх склад і назви , фізичні властивості . Поширеність у природі.
Домашнє завдання : опрацювати параграф 23, 24. Вправа 2,3 стр 95.
Вивчення нового матеріалу.
Дивитись відео за посиланням:
Узагальнення
Виконати в зошит наступні задання
1. Розподілити речовини за класами: HCl, Cu(NO3)2, Mg(OH)2, H2SO4, FeO, ZnS, NaOH, AlCl3, BaCO3, K2O, Cr2(SO4)3, Co(OH)3, NiBr2. Дати назви речовинам.
2. Серед запропонованих формул виберіть формули оксидів, кислот, основ, солей та запишіть їх у відповідний стовпчик таблиці:
MnO2, H2SO4, NaOH, Ca(OH)2, CuSO4, N2O5, HNO3, Al2(SO4)3:
| Оксиди | Кислоти | Основи | Солі |
|
|
|
|
|
3. Установіть відповідність між назвою та формулою оксиду.
| Назва оксиду |
|
| Формула оксиду |
| а) Кальцій оксид | 1) CO |
| б) Карбон (IV) оксид | 2) CaO |
| в) Карбон (ІІ) оксид | 3) CO2 |
| г) Нітроген (І) оксид | 4) N2O |
| д) Натрій оксид | 5) Na2O |
| е) Калій оксид | 6) K2O |
Домашнє завдання.
Опрацювати параграф 28 у підручнику.
15.02
Узагальнення вивченогоз теми: Кількість речовини. Розрахунки за хімічними формулами.(виконану роботу надіслати на Viber до 18.02)
Варіант 1
І. Початковий рівень (0,5 б.)
1. Укажіть символ, яким позначається кількість речовини :
а) М б) V в)ν г) ρ
2. Вкажіть значення молярного об’єму за нормальних умов
а) 24,2 л/моль б) 22,4 л/моль в) 2,24 л/моль г) 29 л/моль
3.Вкажіть одиницю вимірювання кількості речовини ν :
А) г / моль б) моль в) л/моль г) а.о.м.
4. Зазначте формулу, за якою можна обчислити кількість речовини:
А) ν =m/M б) ν = M/m в) ν = mM
ІІ.Середній рівень (1 б.)
5. Вкажіть кількість речовини 1,5×1023 молекул кисню:
А) 0,5 моль б) 0,25 моль в) 1 моль г) 0, 125 моль
6. Вкажіть масу 0,2 моль сірки:
А) 6,4 г б) 3,2 г в) 32 г г) 0,64 г
7. Встановіть відповідність між величинами та одиницями вимірювання :
1. ν а) л/моль
2. m б) л
3. М в) г
4. Vm г) г/моль
д) моль
ІІІ. Достатній рівень (1,5)
8. Вкажіть відносну густину кисню за повітрям :
А) 1,1 б) 1 в) 0,9 г) 10
9. Вкажіть об’єм водню, кількістю речовини 1 моль:
А) 2,24 л б) 24,2 л в) 22,4 л г) 11,2 л
ІV.Високий рівень (2 б)
10. 10. Вкажіть число молекул води кількістю речовини 0,2 моль
а) 6,02×1023 б) 3,01×1023 в)1,204×1024 г) 1,204×1023
11. Заповніть пропуски в таблиці, керуючись зазначеними в ній відомостями про речовину
|
| AlСІ3 |
| m, г | 26,7 |
| M, г/моль |
|
| ν, моль |
|
| N, частинок |
|
| V, л |
|
Кількість речовини. Розрахунки за хімічними формулами
ІІ варіант
І Початковий рівень
1. Укажіть символ, яким позначається молярна маса :
а) М б) V в)ν г) ρ
2. Вкажіть значення сталої Авогадро:
А) 6,02×10-23 б) 6,02×1023 в)6,02×1022 г) 6,02×1024
3. Вкажіть молярну масу заліза (г/моль)
А) 26 б) 28 в) 56 г) 112
4. Вкажіть одиницю вимірювання молярної маси М :
А) г / моль б) моль в) л/моль г) а.о.м.
ІІ. Середній рівень
5. Вкажіть формулу, за якою можна обчислити кількість речовини:
А) ν =Vm/V б) ν = V·Vm в) ν = V/Vm
6. Вкажіть масу 1 моль водню
А) 1 г б) 2 г в) 4 г г) 0,1 г
7. Встановіть відповідність між величинами та одиницями вимірювання :
1. ν а) л/моль
2. m б) л
3. М в) г
4. Vm г) г/моль
5. D д) моль
ІІІ. Достатній рівень
8. Вкажіть відносну густину вуглекислого газу за киснем
А) 0,73 б) 1,375 в) 3 г) 1.
9. Вкажіть кількість речовини 2,24 л хлору :
А) 0,1 моль б) 0,5 моль в) 1 моль г) 0,01 моль
IV. Високий рівень
10. Вкажіть об’єм 0,5 моль водню:
А) 11,2 л б) 1,12 л в) 22,4 л г) 1 л
11.Заповніть пропуски в таблиці, керуючись зазначеними в ній відомостями про речовину
|
| Al(OH)3 |
| m, г |
|
| M, г/моль |
|
| ν, моль |
|
| N, частинок | 12,04·1023 |
| V, л |
Домашнє завдання
· Повторити параграфи 19-22.
· Виконати протилежний варіант.
11.02
Тема: « Відносна густина газів.»
Хід уроку
Вивчення нового матеріалу
Що ми бачимо з цієї таблиці?
| Формула газу | Маса | Молярна маса | Кількість речовини | Об’єм |
| N2 | 14 г | 28 г/моль | 0,5 моль | 11,2л |
| H2 | 1г | 2 г/моль | 0,5 моль | 11,2л |
| CO2 | 44 г | 44 г/моль | 1 моль | 22,4 л |
| CH4 | 16 г | 16 г/моль | 1 моль | 22,4 л |
| O2 | 64г | 32 г/моль | 2 моль | 44,8 л |
| NH3 | 34 г | 17 г/моль | 2 моль | 44,8 л |
Ми бачимо, що різні гази, маючи однакову кількість речовини, займають однаковий об’єм, але мають різну масу. Це пов’язано з тим, що різні гази мають різну густину. Пригадаємо формулу, за якою обчислюється густина:
ρ = m/V
Давайте візьмемо два різні гази кількістю речовини 1 моль і порівняємо їхню густину за н.у.
ρ1 = М1/Vm, ρ2 = М2/Vm ,
Тоді співвідношення густин: ρ1/ ρ2 = М1• Vm/ М2• Vm= М1/ М2
таке співвідношення називають відносною густиною газів і позначають D. Це безрозмірна величина, що показує, у скільки разів один газ важчий або легший за інший.
D = М1/ М2
Знаючи відносну густину газу, можна знайти молярну масу газу:
М1= D • М2
Отже, відносна густина газу – це величина, яка показує у скільки разів один газ легший чи важчий відносно іншого газу.
Повернемося до історії про печеру і з’ясуємо, вуглекислий газ легший чи важчий за повітря. Для цього потрібно знати молярну масу повітря. Вона становить 29 г/моль.
Закріплення вивченого матеріалу
Задача 1. Обчисліть відносну густину карбон (ІV) оксиду за повітрям.
| Дано: СO2, М(повітря)=29г/моль |
D = М1/ М2 | Розв’язання:
1.Визначаємо відносну густину СО2 за повітрям =44г/моль / 29г/моль=1,52
|
| Dпов(СO2) – ? |
Відповідь : Dпов(СO2) =1,52
Отже, бачимо, що вуглекислий газ важчий за повітря, а ми знаємо, що важчі речовини опускаються донизу.
Задача 2. Обчисліть густину за воднем таких газів: а) хлороводню HCl; б) сірководню H2S; в) амоніаку NH3.
Задача 3. Обчисліть молярну масу і визначте молекулярну формулу невідомого оксиду Нітрогену, якщо відносна густина його за амоніаком дорівнює 4,47.
| Дано: DNH3(N2OX)=4,47 |
М1= D • М2 | Розв’язання:
1.Виходячи з формули : М(N2OX)=4,47•17г/моль=76г/моль 2. Складаємо рівняння і визначаємо формулу: М(N2OX)=14•2+16х=28+16х 28+16х=76 16х=48 Х=3 N2O3
|
| М (N2OX) - ? |
Відповідь: М (N2O3)=76 г/моль.
Задача 4. За нормальних умов 12,75 г невідомого газу X займає об’єм 16,8 л. Обчисліть відносну густину цього газу за воднем.
Домашнє завдання: опрацювати поданий матеріал, параграф 22 виконати вправу 4 ст.85
21.01
| Тема
| Кількість речовини. Моль — одиниця вимірювання кількості речовини. Стала Авогадро.
|
| Базові поняття й терміни | Атом, молекула, кількість речовини, моль, стала Авогадро. |
АКТУАЛІЗАЦІЯ ОПОРНИХ ЗНАНЬ
Хімічний диктант.( в зошит)
. Складіть формули сполук:
1) калій сульфіду ;
2) ферум (ІІІ) хлориду;
3) манган (IV) оксиду;
4) барій флуориду;
5) кальцій сульфіду;
6) алюміній оксиду.
7) карбон (ІІ) оксиду;
8) сульфур (VI) оксиду;
9) літій сульфіду;
10) нітроген (IV) оксиду;
11) карбон (IV) оксиду;
ВИВЧЕННЯ НОВОГО МАТЕРІАЛУ
Дивитись відео: https://www.youtube.com/watch?v=hn-RGL54U0s
1. ПОНЯТТЯ ПРО КІЛЬКІСТЬ РЕЧОВИНИ.
Будь-яка фізична величина — це певна характеристика об'єктів або явищ, яка може бути виміряна. Наприклад, властивості інертності тіла відповідає величина, яку називають масою, властивості просторової протяжності відповідає величина, яку називають довжиною.
У хімії, крім використання таких величин, як «маса» й «об'єм», застосовують величину «кількість речовини».
Запис в зошит
Кількість речовини — це фізична величина, обумовлена числом структурних елементів: атомів, молекул, йонів, електронів або груп атомів.
Кількість речовини позначається літерою n (або ν).
2. МОЛЬ - ОДИНИЦЯ ВИМІРЮВАННЯ КІЛЬКОСТІ РЕЧОВИНИ.
Будь-яка фізична величина має свою одиницю вимірювання: маса вимірюється в грамах, довжина — в метрах.
Розповідь учителя.
Кількість структурних елементів можна вимірювати в штуках. Тільки атоми чи молекули дуже незручно вимірювати в штуках, тому що побачити або вибрати одну молекулу надзвичайно важко. Навіть якщо використовувати кратні величини — кілоштуки (103) або гігаштуки (109), то й такі кількості дуже важко відміряти. Тому хіміки ввели дуже велику порцію для вимірювання кількості речовини — 6,02∙1023 штук. На честь відомого італійського вченого Амедео Авогадро ця величина називається «стала Авогадро» й позначається NА
NA =6,02∙1023 1/моль
Запис в зошит
Одиниця вимірювання кількості речовини — моль.
1 моль — це така кількість речовини, яка містить 6,02∙1023 ( ≈6∙1023) атомів або молекул.
Також використовуються кратні величини — кіломоль (кмоль, 103 моль), мілімоль (ммоль, 10-3 моль), мікромоль (мкмоль, 10-6 моль).
Число Авогадро — це дуже велике число. Наприклад, якби всю поверхню Землі (включаючи річки, озера, моря й океани) вистелити рівномірним шаром такої кількості однодоларових купюр, то утворився б шар висотою 2 метри. Проте молекули, які ми рахуємо за допомогою сталої Авогадро, є дуже маленькими часточками. Якщо ми візьмемо 6 • 1023 молекул води, то навіть не зможемо наповнити склянку.
РОЗРАХУНОК КІЛЬКОСТІ РЕЧОВИНИ
ЗА ВІДОМИМ ЧИСЛОМ АТОМІВ І МОЛЕКУЛ.
Розповідь учителя.
Для розрахунку кількості речовини використовується формула: n=N/NA
, де N — кількість часточок (або атомів молекул).
Розв'язування задач.
https://www.youtube.com/watch?v=itDETNqJ_i0
УЗАГАЛЬНЕННЯ
1. Скільки молекул міститься у воді кількістю речовини 15 моль?
ДОМАШНЄ ЗАВДАННЯ
Вивчити § 19 підручника .
Виконати завдання 3; 4 ст. 78.
18. 01. 2021
Практична робота №1 Дослідження фізичних властивостей, речовин з різними типами кристалічних граток
( наприклад: цукру, кухонної солі, графіту).
Для виконнання роботи користуйтесь відео: ttps://www.youtube.com/watch?v=d-oZmXUCyZc
14.01.2021
Тема: Залежність фізичних властивостей речовин від типів кристалічних ґраток.
Повторення
Гра«Вірю –не вірю» (письмово).
1. Йонний зв’язок виникає між йонами
2. Йони – це нейтральні частинки
3. Йони – це заряджені частинки
4. Ковалентний зв’язок буває двох типів – полярний і неполярний
5. Ковалентний полярний зв’язок утворюється між атомами з однаковою електронегативністю
6. Ковалентний неполярний зв’язок утворюється між атомами одного і того ж неметалу
7. Ковалентний неполярний зв’язок утворюється між атомами з різною електронегативністю
8. NaCl – сполука з йонним зв’язком
9. О2 – сполука з ковалентним полярним зв’язком
10. HCl –сполука з йонним зв’язком
11.Атом Cl має 5 валентних електронів в основному стані.
4. Вивчення нового матеріалу:
4.. Будова твердих речовин.
Запитання:
1. Які частинки утворюють речовини?
(Тобі вже відомі такі частинки, як атоми, молекули, йони. Це відносно проста форма організації речовини. У стандартних умовах ці частинки, як правило, індивідуально не існують.)
2. Які речовини утворюють частинки? (За допомогою різних типів хімічних зв'язків вони
об'єднуються й утворюють вищу форму організації речовини — хімічні сполуки.)
3. Як поділяються хімічні сполуки? (прості і складні речовини. Залежно від фізичних умов
речовини можуть існувати в різнихагрегатних станах.)
4. Які ви знаєте агрегатні стани хімічних сполук? ( з уроків природознавства та фізики: твердий, рідкий та газуватий стан)
Під час бесіди складаємо схему
Агрегатний стан
(Якщо гази характеризуються повною невпорядкованістю розташування молекул одна відносно одної, то в рідинах деяка впорядкованість частинок спостерігається. Адже для рідин характерна наявність певного об'єму, хоча й відсутня певна форма. Рідини займають проміжне місце між газами і твердими тілами, яким властивий суворий порядок розташування частинок, що утворюють речовину.У твердих речовинах частинки розташовані у просторі суворо закономірно для кожної речовини.)
Будова твердих речовин ( в зошит)
Аморфна Кристалічна
Структурні частинки речовини Структурні частинки речовини розміщуються
розміщуються безладно впорядковано
Приклад: глина, скло Приклад: кухонна сіль, графіт
Відомо, що у твердих речовинах частинки, що їх утворюють, розташовані у просторі закономірно для кожної речовини.Кожна кристалічна речовина має свою кристалічну гратку.
Кристалічна гратка – це розміщення в просторі йонів, атомів або молекул у певному систематичному порядку. (У кристалічних речовинах атоми, молекули та йони розташовані упорядковано, на певних відстанях. Таке закономірне розташування частинок у кристалах називають кристалічною ґраткою. Щоб якось уявити цю закономірність, у тривимірному просторі об’єднаємо центри молекул прямими лініями, які перетинаються. При цьому утвориться просторовий каркас, який називають кристалічною ґраткою. Місця, в яких лінії перетинаються, називають вузлами кристалічних ґраток ( демонстрація моделей кристалічних ґраток)
Кристалічні ґратки – модель, за допомогою якої описують внутрішню будову кристалів)
Класифікація кристалічних ґраток.
Залежно від природи частинок, що містяться у вузлах кристалічних ґраток, та сили взаємодії між частинками визначають тип ґраток: йонні, атомні, молекулярні.
Відомі ще й металічні кристалічні ґратки, їх вивчатимеш пізніше
Йонна кристалічна гратка
У вузлах йонних кристалічних граток лежать йони, тому гратки і отримали таку назву – йонні.Йонні кристалічні гратки характерні для речовин з йонним зв’язком.
Я розповім про те, які сили діють в йонних гратках і як це впливає на властивості речовин.
Оскільки йони заряджені протилежно, між ними виникають значні сили притягання. Зруйнувати таку гратку нелегко. Для того, щоб зруйнувати кристал, необхідно затратити велику кількість енергії, саме тому всі речовини з йонною граткою є твердими. Температура плавлення їх досить висока. Наприклад, кухонну сіль можна розплавити при температурі 801˚С. Рекордсмен по тугоплавкості серед йонних сполук – магній оксид. Його можна розплавити при температурі 2800˚С.
Це нелеткі речовини, тому не мають запаху. Вони крихкі. Більшість добре розчиняється у воді, розчини таких речовин проводять струм.
Речовини з йонною кристалічною граткою можна зустріти в природі, в побуті. Ви вже чули, що до речовин з йонною граткою відноситься всім відома кухонна сіль – натрій хлорид. Інші солі також мають таку решітку. Луги, наприклад, натрій гідроксид, кальцій гідроксид. Оксиди металів, наприклад, алюміній оксид – Аl2O3.
Атомна кристалічна гратка
Раз гратка називається атомною, то у вузлах гратки лежать атоми. Перед вами схема будови кристала алмаза. Кожна кулька – це атом Карбону. Всі атоми розташовані один від одного на однаковій відстані. А це схема будови кристала графіту. Тут у вузлах лежать ті ж самі атоми Карбону, але розташування атомів інше – шарувате. Тут немає окремих йонів або молекул. Весь кристал являє собою неначе одну велетенську молекулу.
Ви тільки що чули, що в йонних гратках діють значні сили притягання між йонами. Між атомами діють ще більші сили притягання, утворюються дуже міцні ковалентні зв'язки. Зруйнувати їх ще важче, ніж зв'язки між йонами. Тому всі речовини з атомними кристалічними гратками дуже тверді, дуже тугоплавкі, нелеткі. Наприклад, температура плавлення алмаза становить 3500˚С. Крім того, алмаз є самою твердою речовиною в природі.
Ці речовини не розчиняються у воді. Вони не проводять струм, або бувають напівпровідниками.
Атомні гратки має невелика кількість речовин. Це алмаз, з якого роблять діаманти, алмазом ріжуть скло, бурять гірські породи. Зараз у кожного з вас теж є речовина з атомною кристалічною граткою. Це графіт, який знаходиться в олівцях. Нам добре знайомий пісок – SO2. Це також речовина з атомною граткою. Цей предмет, я думаю, вам також знайомий. Ним точимо ножі, сапи завдяки його великій твердості. Називається речовина – силіцій карбід. У його кристалічній гратці чергуються атоми Карбону і Силіцію. Саме ці атоми утворюють атомну кристалічну гратку.
Молекулярна кристалічна гратка
1. Ще один тип граток, що існує в природі, – молекулярні кристалічні ґратки. Речовини з такими гратками дуже відрізняються від речовин з йонними та атомними гратками. Причина полягає в тому, що у вузлах лежать молекули. На цьому малюнку зображена кристалічна гратка йоду. У вузлах гратки розташовані молекули йоду – І2. А на цьому малюнку зображена гратка вуглекислого газу. За певних умов він може ставати твердим, тоді його називають сухим льодом. У вузлах лежать молекули СО2. А ось це модель кристалу звичайного льоду. У його вузлах лежать молекули води – Н2О. Молекулярні кристалічні гратки можуть утворювати речови, що мають ковалентні зв’язки.
2. Між молекулами діють дуже слабкі сили міжмолекулярного тяжіння. Їх називають силами Ван-дер-Ваальса. Якщо сили притягання слабкі, то й зруйнувати їх дуже легко. Тому всі речовини із молекулярною кристалічною граткою мають невелику твердість, вони легкоплавкі. Наприклад, кристали йоду можна розплавити про 30˚С, а лід плавиться вже при 0˚С. Це леткі речовини, тому майже всі мають запах. Пригадайте нафталін, яким відлякують міль від одягу, що зберігається в шафах. Речовини з молекулярною граткою не проводять струм. Вони мають різну розчинність у воді.
3. Речовини з молекулярною граткою дуже поширені. Я вам покажу деякі з них. Ось кристали йоду. Спиртовий розчин йоду використовують в медицині, він є у кожного із нас вдома. А це цукор. Звичайний цукор, з яким ми п’ємо чай. Молекулярну гратку має лід. Досить його дістати із холодильника, як він починає танути, що доводить наявність молекулярної гратки.
Користуючись опорним конспектом заповнимо таблицю «Тип кристалічних ґраток і властивості речовин.» (в зошит)
| Показники. | Тип кристалічних ґраток і властивості речовин | ||
|
| молекулярна | атомна | йонна |
| Складові частинки граток | полярні й неполярні молекули | атоми | йони |
| Тип хімічного зв’язку | ковалентний | ковалентний | йонний |
| Міцність зв’язку | мала | велика | велика |
| Температура кипіння і плавлення | невисокі | високі | високі |
| Леткість | леткі | нелеткі | нелеткі |
| Твердість, крихкість | м'які | тверді, крихкі | тверді, крихкі |
| Електропровідність | діелектрики | діелектрики, або напівпровідники | електропровідні в водних розчинах чи розплавах |
| Розчинність у воді | розчинні – з полярними зв’язками, нерозчинні – з неполярними зв’язками | нерозчинні | розчинні |
Інструкція з визначення типу кристалічної гратки
Визначити до якої групи відноситься дана речовина:
- Проста речовина – визначити метал чи неметал:
Ме – мають металічну кристалічну гратку;
неМе – мають молекулярну кристалічну гратку;
винятки – деякі неМе мають атомну кристалічну гратку.
- Складна речовина – визначити клас речовини:
МехОу – йонну кристалічну гратку;
неМехОу – молекулярну кристалічну гратку;
Ме(ОН)х – йонну кристалічну гратку;
НхAn – йонну кристалічну гратку;
MeхAnу – йонну кристалічну гратку.
Завдання виконати в зошит.
Визначити тип кристалічних граток хімічних сполук: Са, О2, SO3, HCl
Залежність між хімічним зв’язком, типом кристалічної решітки і фізичними властивостями.
У кристалічних речовинах атоми, молекули, йони розміщуються в певному порядку, утворюючи кристалічні ґратки Кристалічні ґратки – модель, за допомогою якої описують внутрішню будову кристалів.. Розрізняють атомні, молекулярні, йонні та металічні кристалічні ґратки.
Між будовою речовини, яка визначається типом хімічного зв'язку і типом кристалічних ґраток, та її властивостями існує певна залежність: чим міцніший хімічний зв'язок, що утримує частинки у вузлах кристалічних ґраток, тим міцніші кристали, тим твердіша речовина, тим вищі її температури плавлення і кипіння. А тому, якщо відома будова речовини, можна прогнозувати її властивості, і навпаки – якщо відомі властивості речовини, можна зробити висновок про її можливу будову.
Узагальнення
Тестові завдання:
1. Молекулярні кристалічні ґратки можуть мати речовини з хімічним зв'язком
а) йонним; в) ковалентним полярним;
б) металічним; г) ковалентним неполярним.
2. Речовини з молекулярними кристалічними ґратками
а) легкоплавкі; в) добре проводять електричний струм;
б) леткі; г) мають низьку теплопровідність.
3. Речовина, що має найвищу температуру плавлення, — це
а) йод; б) лід; в) кальцій флуорид.
Додаткові завдання
4*. Речовина, хімічні зв'язки в якій сформовані між атомами елементів із зарядами ядер +1 і +16, у твердому стані має кристалічні ґраткиа) йонні; б) молекулярні; в) атомні.
5*. Речовина, утворена елементами із скороченими електронними конфігураціями атомів...3s1 і...3s23p5, має кристалічні ґратки а) атомні; б) йонні; в) молекулярні.
Домашнє завдання: Вивчити поданий матеріал та виконати вказані вище завдання..
9.11, 12.11
Електронні та графічні електронні формули атомів хімічних елементів № 1-№ 20 Поняття про радіус атома.
Актуалізація опорних знань.
Учні використовують таблицю: періодичну систему хімічних елементів Д.І.Менделєєва.
Експрес-опитування.
1. Вкажіть заряд ядра атома цинку.
2. Вкажіть протонне число Фосфору.
3. Запишіть символ нукліду Хлору з атомною масою 37.
4. Запишіть символ нукліду Калію з атомною масою 41.
5. Вкажіть число нейтронів в ядрі нукліду Карбону.
6. Вкажіть елемент нуклонне число якого дорівнює 55.
7. Запишіть формулу нукліду тритію.
8. Скільки протонів і нейтронів в ядрі нукліду Літію.
9. Нуклід має 10 нейтронів і відносну атомну масу 19. Визначити, що це за хімічний елемент.
10. Елемент стоїть у ІІІ групі. Відносна молекулярна маса його вищого оксиду дорівнює
Вивчення нового матеріалу
1. Будова електронних оболонок атомів елементів.
Стан електрона в атомі описує наука, яка називається квантова механіка. Згідно з уявленнями квантової механіки електрон в атомі поводиться і як частинка і як хвиля. Електрон в атомі не має траєкторії руху, але існує імовірність його перебування навколо ядра, це місце називають електронною хмарою, або електронною густиною, або орбіталлю.
Орбіталь – це простір навколо ядра в якому перебуває електрон найімовірніше.
Орбіта лі мають різні розміри і різні форми:
s- орбіталь має сферичну форму,
p- орбіталь має форму гантелі,
d- орбіталь – форму пелюстки.
Однакові за розмірами орбіта лі утворюють електронні шари.
Про кількість електронних шарів в атомі можна дізнатись по номеру періода.
Електронні шари називають енергетичними рівнями, так як електрони які на них містяться мають певний запас енергії. Найменший запас енергії мають електрони першого енергетичного рівня і електрони кожного наступного рівня характеризуються більшим запасом енергії.
Енергетичні рівні нумеруються починаючи від ядра: 1, 2, 3, 4, 5, 6, 7
n або K, L, M, H, O, P, Q
Різні рівні мають різну кількість орбіта лей: n s s s s
n2 p p p
d d
f
Заповнення орбіта лей
1. Черговість заповнення – принцип найменшої енергії 1s
(правило Клечковського). 2s 2p
2. На кожній орбіта лі може бути не більше 2-х електронів 3s 3p 3d
(принцип Паулі). 4s 4p 4d 4f
3. Спочатку електрони заповнюють орбіта лі по одному, 5s 5p 5d
а коли всі орбіта лі на підрівні вичерпані, вони заповнюються 6s 6p 6d
повністю (правило Хунда). 7s 7p
Послідовність заповнення орбіталей електронами
1 2 3 4 5 6 7
1s 2s2p 3s3p 4s3d4p 5s4d5p 6s4f5d6p 7s5f6d7p
Радіус атома – важлива його характеристика. Чим більший атомний радіус, тим слабкіше утримуються зовнішні електрони. І навпаки, із зменшенням атомного радіуса електрони сильніше притягуються до ядра.
Радіус атома – це відстань від центра ядра до сферичної поверхні, якої торкаються орбіталі з електронами останнього енергетичного рівня.
- Чим більший заряд ядра атома елемента, тим радіус атома менший (за умови, що кількість електронних оболонок однакова).
- Чим більше електронних оболонок має атом, тим більший його радіус.
| У періоді атомний радіус зменшується зліва направо. | Це пояснюється збільшенням сил притягання електронів і зростанням заряду ядра. Уявимо собі енергетичні рівні у вигляді витків спіралі. Для елементів V періоду, таких витків буде п’ять. У атомах елементів на початку періоду відстань між витками більша, а у атомах елементів ближче до кінця періоду ці витки будуть більш щільні. |
| У підгрупах зверху вниз атомний радіус зростає. | Внаслідок появи додаткового енергетичного рівня збільшується об’єм атома, а значить, і його радіус. Наприклад, у атома Літію два енергетичні рівні, а у атома Францію їх сім. Радіус атома Францію більший від радіуса атома Літію. |
Домашнє завдання.
Опрацювати параграф 12, конспект.
Вправа 5., 8 стр. 49.
05.11
Будова електронних оболонок атомів хімічних елементів №1-20
Повторення
Гра «Укажіть елемент» (в зошит)
- Порядковий номер елемента 13.
- Заряд ядра атома + 20.
- Відносна атомна маса елемента 52.
- 3агальна кількість електронів у атомі 15.
- У ядрі цього атома 21 протон.
- Елемент II періоду V групи.
- Радіоактивний елемент VII періоду II групи головної підгрупи.
- Елемент II групи, атом якого має 2 енергетичні рівні.
- Сума протонів та нейтронів у атомі цього елемента – 24.
- Сума протонів та нейтронів у атомі цього елемента – 48.
- Хімічний елемент входить до складу сульфатної кислоти, мешкає в III періоді VI групи.
- Заряд ядра атома +17.
- Кількість електронів у атомі 25.
- Елемент, що відповідає за міцність кісток людини. Його відносна атомна маса – 40.
- У ядрі атома 29 протонів.
- Загальна кількість електронів у атомі 7.
- Нуклонне число в атомі елемента 65.
- Існування цього елемента передбачив і описав його властивості Д.І. Менделєєв. Елемент знаходиться в ІV періоді III групи головної підгрупи.
Вивчення нового матеріалу
Усе в навколишньому світі прагне перейти в стан із найменшою енергією. Електрони в атомі розміщуються так, щоб їх енергія була мінімальною. Розглянемо, як заповнюють електрони енергетичні рівні та підрівні у елементів І-ІІІ періодів. Для кращого запам'ятовування скористаємось алгоритмом.
Алгоритм складання електронної формули:
1. Визначаємо кількість електронів за протонним числом (порядковим номером).
2. Визначаємо кількість енергетичних рівнів за номером періода.
3. З'ясовуємо за таблицею (додаток 2) кількість підрівнів і їх позначення.
4. Визначаємо максимальну кількість електронів на енергетичних рівнях заформулою .
5. Пам'ятаємо, що на одній орбіталі одночасно може знаходитись не більше 2-х електронів.
Учитель: Назвіть елемент І періоду?
Визначте який заряд ядра у атома Гідрогена?
Скільки електронів у атома Гідрогена?
Навколо позитивно зарядженого ядра рухається 1 електрон, що розташований на першому енергетичному рівні.Проілюструємо вище сказане електронною і графічною формулою: ![]() .
.
Завдання: Складіть електронні та графічні формули для атомів Гелію, Літію ( в зошит )
У атома Літію електрони розташовуються на двох енергетичних рівнях — перший рівень внутрішній, а другий рівень — зовнішній. Електрони, розміщені на зовнішньому енергетичному рівні називають зовнішніми.
У періодичній системі використовують скорочений запис електронної формули. Для атома Літію він є таким: [Не] 2 s 1. Символ елемента Гелію у квадратних дужках означає, що внутрішня частина електронної оболонки атома Літію така сама, як і електронна оболонка атома Гелію (1S2 ). Скорочені записи електронних формул атомів містяться в короткому варіанті періодичної системи.
Кількість електронів на зовнішньому енергетичному рівні у атомі вказує на можливе значення валентності елемента та відповідає номеру групи.
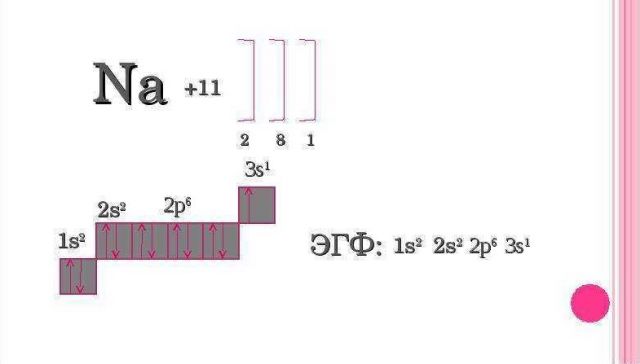
В атомі елемента № 11 Натрію починається заповнення третього енергетичного рівня. На ньому з’являється один електрон:
Узагальнення
- Знайдіть електронну формулу Нітрогену.
а) 1s22s22p61s22s5;
б) 1s22р5;
в) 1s2р5;
г) 1s22s22р3.
- Яка електронна конфігурація відтворює будову атома Оксигену?
а) 1s22s23s23p2;
б) 1s2;
в) 1s22s32p4;
г)1s22s22p4; .
- Яка електронна конфігурація відтворює будову атома Сульфуру?
а)1s22s22p63s23p23d2;
б)1s22s22p63s23d4;
в)1s22s22p43d23s23p4;
г)1s22s22p63s23p4.
Домашнє завданя
Опрацювати параграф 11, конспект. Завдання 9 стр. 46.
02.11.2020
Електронні орбіталі. Енергетичні рівні та підрівні; їх заповнення електронами в атомах хімічних елементів № 1-20
Поторення
Дайте відповіді на питання ( усно)
- Як побудований атом?
- Що таке – електрон?
- В чому особливість руху електрона навколо ядра?
- Що таке орбіталь?
- Чим відмінні електронні орбіталі?
6. Які форми може мати електронна хмара?
Вивчення нового матеріалу
Дивитись відео :https://www.youtube.com/watch?v=cJDSI-Wyivc&t=20s
І. Зв’язокміж будовою атома та його положенням у періодичній системі
Знаючи положення елемента у періодичній системі можна визначити будову його атома
-
Поняття в періодичній системі
Зв’язок з будовою атома
І. Порядковий номер елемента
1. Заряд ядра
2. Кількість протонів
3. Кількість електронів
ІІ. Номер періоду
Кількість електронних шарів
(енергетичних рівнів)
ІІІ. Номер групи
Кількість електронів на зовнішньому шарі для елементів головних підгруп
Яку будову має атом магнію?
- Порядковий номер 12, тому заряд ядра +12, у ядрі 12 протонів, навколо ядра обертаються 12 електронів.
- 3 період, тому електрони рухаються по 3 шарам
- 2 група головна підгрупа, тому на зовнішньому енергетичному рівні (шарі) знаходиться 2 електрона
Поняття про енергетичні рівні
1. Орбіталі характеризуються не тільки формою, але й енергією. Декілька орбіталей, що мають рівну або близьку енергію, утворюють енергетичний рівень або енергетичний шар.
Отже, в електронній оболонці електрони розташовуються шарами – електронними шарами (енергетичними рівнями).
2. Виділяють 7 рівнів.
Енергетичний рівень позначають арабськими цифрами від 1 до 7 (n = 1, 2, 3, 4, … 7) або великими літерами латинського алфавіту K, L, M, N, O, P Q.
Номер періоду, в якому розміщений хімічний елемент, вказує на кількість енергетичних рівнів (шарів), по яких рухаються електрони.
Наприклад.
Хімічний елемент Натрій розташований в третьому періоді, який вказує на наявність трьох енергетичних рівнів для атома Натрію (1, 2, 3).Таку ж кількість рівнів мають атоми елементи цього періоду. (Mg, Al, Si, P, Cl, Ar).
3. Чим ближче до ядра розміщений енергетичний рівень, тим меншим запасом енергії наділені його електрони.
Електрони, що рухаються на віддаленішому від ядра енергетичному рівні, мають більший запас енергії.
Розподілелектронів на енергетичнихрівнях
На кожному енергетичному рівні може перебувати суворо визначене число електронів. Максимальна кількість електронів на кожному рівні обчислюється за формулою: N = 2n2
Де
n =1, N = 2∙12 = 2
n= 2, N = 2∙22 = 8
n= 3, N = 2∙32 =18
n = 4, N = 2∙42 =32
На першому енергетичному рівні може бути не більше 2 електронів
на другому не більше 8
на третьому не більше 18
на четвертому не більше 32
ІV. Поняття про підрівні
1. За формою і енергієюатомнихорбіталейелектрони одного рівняподіляються на підрівні.
Число енергетичних підрівнів дорівнює номеру енергетичного рівня.
Підрівні позначаються так само, як орбіталі (s, p, d, f).
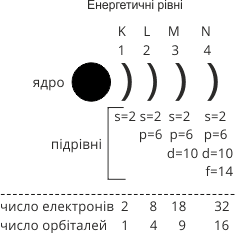
- перший енергетичний рівень складається з одного s-підрівня, утвореного однією s-орбіталлю;максимальна ємність рівня – 2 електрони;
-другий рівень складається з двох підрівнів (s i p), утворених однією s-орбіталлю і трьома p-орбіталями (всього чотири);максимальна ємність рівня – 8 електронів;
-третій рівень складається з трьох підрівнів (s, p, i d), утворених однією s-орбіталлю, трьома р-орбіталями і п’ятьма d-орбіталями (всього девять);максимальна ємність рівня – 18 електронів;
- четвертий енергетичний рівень складається з чотирьох підрівнів (s, p, d, f), утворених однією s-орбіталлю, трьома р-орбіталями , п’ятьма d-орбіталями і сімома орбіталями( всього шістнадцять); максимальна ємність рівня – 32 електрони.
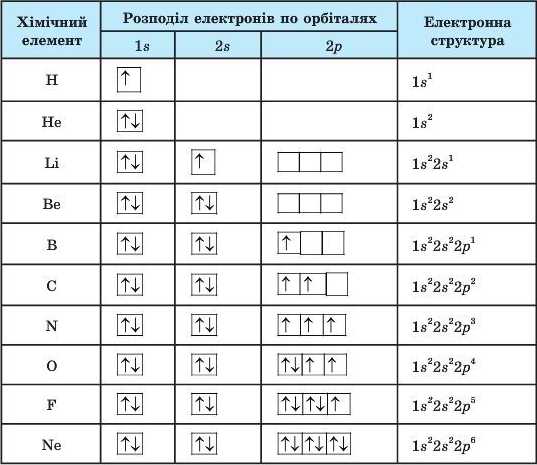
Електронна формула
Заповнення електронами енергетичних рівнів і підрівнів відображають за допомогою електронних і графічних електронних формул атомів.
1. Електронна формула атома – це запис розподілу електронів в атомі за допомогою коефіцієнтів, якими позначаються енергетичні рівні (1, 2, 3 …7), символів підрівнів (s, p, d, f) та верхніх індексів, що дорівнюють числу електронів на підрівні.
Наприклад
- Електронна формула атома Гелію:
1s2 (читається один-ес-два) позначено перший енергетичний рівень з наявним одним s-підрівнем, заповненим двома електронами, тобто рівень завершений .
- Електронна формула атома Нітрогену
1s22s22р3 (читається один-ес-два-два-ес-два-два-пе-три) позначеноперші два енергетичнірівні: на першомурівніміститься два s-електрони, на другому – два s-електрони та три р-електрони (цеелектронна формула атома Нітрогену)
- Електронна формула атома Калію 39K 1s22s22p63s23p64s1.
2. Правила заповнення електронами енергетичних рівнів і підрівнів
1). Спочатку електронами заповнюється перший енергетичний рівень, потім другий, і тільки після остаточного заповнення другого енергетичного рівня розпочинається заповнення третього рівня.
2).У межах одного енергетичного рівня першим заповнюється s-підрівень, другим – p-підрівень.
3). На одній орбіталі не буває більше двох електронів.
4). Електрони заповнюють орбіталі спочатку по одному, а якщо електронів більше за число орбіталей, то по два.
5). Число електронів в атомі дорівнює порядковому номеру елемента.
Енергетичні рівні, заповнені максимально можливою для них кількістю електронів називаються завершеними, а енергетичні рівні з меншою кількістю електронів – незавершеними.
Графічна електронна формула –це відображення розподілу електронів за енергетичними комірками.
Алгоритм складання електронних і графічних електронних формул атомів хімічних елементів
1. Визначити загальне число електронів у атомі (вказує порядковий номер елемента).
2. Визначити число енергетичних рівнів (вказує номер періоду).
3. Записати можливі підрівні в межах рівня.
4. Дотримуючись правил заповнення електронами енергетичних рівнів та підрівнів, записати електронну формулу атома.
Дивитись відео : https://www.youtube.com/watch?v=M1mXtEB_Wy4
Домашнє завдання
Опрацювати парагрф 10- 11, виконати вправу 9 стр 46.
14. 09.2020
Діагностична робота
| Виберіть одну правильну відповідь | |||||||||||||||||||||
| 1 | Вкажіть назву явища, що відбувається з зміною агрегатного стану та форми речовини:
| ||||||||||||||||||||
| 2 | Вкажіть назву числа перед формулою, що показує кількість частинок:
| ||||||||||||||||||||
| 3 | Вкажіть назву найменшої частинки речовини, що зберігає її хімічні властивості:
| ||||||||||||||||||||
| 4 | Вкажіть частинки, що входять до складу складних речовин:
| ||||||||||||||||||||
| 5 | Вкажіть відносну молекулярну масу кисню:
| ||||||||||||||||||||
| 6 | Вкажіть схему обчислення відносної молекулярної маси Fe3O4:
| ||||||||||||||||||||
| 7 | Вкажіть значення коефіцієнтів у рівнянні К + О2 = К2О:
| ||||||||||||||||||||
| Виберіть кілька правильних відповідей | |||||||||||||||||||||
| 8 | Випишіть з переліку елементи-неметали:
| ||||||||||||||||||||
| 9 | Випишіть формули сполук у яких атоми металів мають валентність II:
| ||||||||||||||||||||
| 10 | Встановіть відповідність між поширенням у природі і хімічним елементом:
| ||||||||||||||||||||
| 11 | Закінчіть рівняння реакції:
| ||||||||||||||||||||
| 12 | Обчисліть відносну молекулярну масу Ca(OH)2. | ||||||||||||||||||||
| 13 | Обчисліть масову частку Оксигену у Ca(OH)2. | ||||||||||||||||||||
Якщо виникають запитання, будь ласка, звертайтеся, контактний номер телефону: 0992396461 або електронна пошта:
rogulicvalentina@gmail.com
22.05
Підсумкова контрольна робота з хімії
ІІ семестр
1. Кількість речовин – це…
а) фізична величина, що показує число структурних частинок ( атомів, молекул, йонів), що міститься у певній її порції;
б) фізична величина, що дорівнює відношенню маси речовини до відповідної кількості речовини;
в) величина, що містить стільки ж структурних частинок ( атомів, молекул, йонів), скільки атомів міститься у 12 г вуглецю;
г) фізична величина, що дорівнює відношенню густини одного газу до густини іншого газу.
2. Одиниця вимірювання молярної маси:
а) моль; б) г∕моль;
в) г; г) л.
3. У кисні О2 кількістю речовини 1 моль міститься:
а)12,04 ∙1023 молекул; б) 6,02∙1023 молекул;
в) 9,02∙1023 молекул; г) 3,01∙1023 молекул.
4. Вкажіть групу речовин, яка містить лише оксиди:
А) FeO, FeS, NO В) K2O, NO, CO2
Б) FeO, KH, SO2 Г) NH3, NaCI, N2O5
5. Вкажіть валентність кислотного залишку ортофосфатної кислоти Н3РО4
А) один В) два
Б) три Г) чотири
6. Вкажіть оксид, який в результаті взаємодії з водою утворює основу:
А) K2O В) CO2
Б) SO3 Г) N2O5
7. Встановіть відповідність між масою газу та його кількістю речовини:
А) 9,6 г озону (О3) 1. 0,8 моль
Б) 1,4 г азоту (N2) 2. 0,04 моль
В) 2,84 г хлору (СІ2) 3. 0,45 моль
Г) 1,6 г водню (Н2) 4. 0,2 моль
5. 0,05 моль
8. Встановіть відповідність між формулою та класом сполук:
А) Na2O 1. Кислота
Б) H3PO4 2. Основа
В) Ca(OH)2 3. Сіль
Г) NaCI 4. Основний оксид
5. Кислотний оксид
9. Встановіть відповідність між реагентами та продуктами реакції:
А) HCI+KOH 1. H2SO4
Б) Na2O+H2O 2. KCI+H2O
В) CaCO3 3. NaOH
Г) SO3+H2O 4. CaO+CO2
5. H2SO3
10. Здійсніть перетворення:
Алюміній→Алюміній оксид→Алюміній гідроксид→Алюміній сульфат→Алюміній хлорид
18.05
Генетичний зв'язок між основними класами неорганічних сполук
Було давно помічено, що речовини, які беруть свій початок від простих речовин — металів, суттєво відрізняються за властивостями від речовин, що беруть початок від неметалів. Тому розрізняють два генетичних ряди: генетичний ряд металів та генетичний ряд неметалів.
Генетичний ряд металів. Генетичний ряд металів має такий
вигляд: _
метал —> основний оксид —>основа (луг) —> сіль.
Метал, що започатковує генетичний ряд, наявний в усіх його складних речовинах, наприклад:
Ca —> CaO —>Са(ОН)2 —>СаС12
- 2Са + 02 = 2СаО;
- СаО + Н20 = Са(ОН)2;
- Са(ОН)2 + 2НС1 = СаС12 + 2Н20.
Звернути увагу учнів.
Правило генетичних зв’язків:
- Кількість стрілочок у схемі відповідає кількості рівнянь хімічних реакцій, які необхідно скласти.
- Сполуки, записані перед стрілочкою, обов’язково мають вступити в хімічну реакцію.
- Сполуки, записані пір ля стрілочки, мають утворитися внаслідок реакції.
Проте, як вам відомо, нерозчинну основу не можна добути з оксиду, піддавши його взаємодії з водою. Тому генетичний зв’язок ускладнюється на одну ланку:
метал —> основний оксид —>сіль —> основа —> інша сіль.
Для заліза та сполук Феруму він має вигляд:
Fe —> FeO—> FeS04 —> Fe(OH)2 —> FeCl2
- 2Fe+O2=2FeO
- FeO + H2SO4=FeSO4+H2O
- FeSO4+2NaOH =Fe(OH)2 +Na2SO4
- Fe(OH)2+2HCl= FeCl2+2H2O
- Генетичний ряд неметалів. Генетичний ряд неметалів вибудовується за тим самим принципом, що й металів, лише гідрат оксиду в ньому не основа, а кислота:
неметал —> кислотний оксид —> кислота —> сіль.
Розглянемо генетичний ряд неметалів на прикладі сірки:
S —> S02 —> Н2S03 —> К2S03
1) S + 02 = S02;
- Н20 + S02 = Н2S03;
- 2КОН + Н2S0з = К2S03 + 2Н20.
- Генетичний ряд неметалів, у якому основою виступає нерозчинна кислота. Цей ряд можна представити за допомогою таких перетворень:
неметал —> кислотний оксид —сіль —> кислота —> кислотний оксид —> неметал.
Наприклад, генетичний ряд Сіліцію:
1 2 3 4 5
Si —> SіO2 —> Na2SiО3 —> Н2 SіО3 —> SiO2 —> Si.
- Si + O2 = SіO2
- SіO2 + 2NaОH = Na2SiО3 + Н2 О
- Na2SiО3 + 2НCl = 2NaCl + Н2SiО3
- Н2SiО3 = SiО2 + Н2 О
- SiО2 = Si + О2
Аналогічно можна одержати кислоту із солі, оксиди з основ і кислот, чисті метали й неметали з їхніх оксидів і солей і т. д. Отже, ви ознайомилися з типовими варіантами генетичних рядів металів і неметалів.
Проте необов’язково, щоб з утворенням солі генетичний ряд завершувався. Його можна продовжити і, зокрема, у зворотному напрямі:
1 2 3 4 5 6 7
Cu —> CuO —> CuS04 —>Cu(OH)2 —> CuCl2 —> Cu(OH)2 —> CuO —> Cu
- 2Cu + 02 = 2CuO;
- CuO + H2S04 - CuS04 + H20;
- CuS04 + 2KOH - Cu(OH)2 + K2S04;
- Cu(OH)2 + 2HC1 - CuCl2 + 2H20.
- CuСl2 + 2NaOH = Cu(OH)2 + NaCl
t
- Си(ОН)2 —> CuO + Н20;
t
- CuO + Н2 —> Cu + Н20.
Узагальнення знань.
Установіть генетичний ланцюжок добування натрій алюмінату.
А Al Cl3
Б Al
В Al (OH)3
Г Al 2O3
1.Al 2. Al 2O3 3. Al Cl3 4. Al (OH)3 5. Na3AlO3
Рівняння реакцій
- 4 Al + 3O2=2Al2O3
- Al2O3+ 6HCl = 2 AlCl3+3H2O
- AlCl3+3NaOH = Al(OH)3 + 3NaCl
- Al(OH)3+3NaOH = Na3AlO3+3H2O
Домашнє завдання: опрацювати параграф 35, виконати №2 ст. 130.
15.05
Практична робота №3. Розв'язування експериментальних завдань
Виконуємо завдання 1, 4, 10 (а,б) на ст. 128.
08.05
Загальні способи добування оксидів, кислот, основ, солей
Опрацьовуємо зміст параграфу 33 ст. 124
№1 ст.125
а) 1) 2Zn + O2 = 2ZnO
2) Zn(OH)2 = ZnO + H2O
№ 2 ст.
а) 1) 2AI + 3H2SO4 = AI2(SO4)3 + 3H2
2) 2AI + 3CuSO4 = AI2(SO4)3 + 3Cu
3) 2AI(OH)3 + 3H2SO4 = AI2(SO4)3 + 6H2O
4) AI2O3 + 3H2SO4 = AI2(SO4)3 + 3H2O
Домашнє завдання: параграф 33, виконати №1 ст. 125(б)
04.05
Практична робота №2. Дослідження властивостей основних класів неорганічних сполук
Виконуємо завдання 3, 6, 7 ст. 123
27.04
Солі: склад і назви, фізичні та хімічні властивості. Поширення у природі.
Солі - складні речовини, до складу яких входять йони металічного елемента й кислотні залишки.
Складаючи формулу солі необхідно записати хімічний символ металічного елемента, поруч кисотний залишок, тоді зазначаємо валентність і розставляємо індекси.
Назви солей складаються з назви металічного елемента та кислотного залишка. Якщо валентність металу змінна, то вона вказується в дужках римськими цифрами. Наприклад К2SO4 - калій сульфат, оскільки SO4 є залишком сульфатної кислоти.
Опрацьвуємо табл.11 на ст. 118.
Фізичні властивості солей, поширення у природі ст. 119.
Хімічні властивості:
1) Солі реагують з металами див. ст. 120
2) Солі реагують з розчинними основами - лугами ст. 121
3) Солі реагують з кислотами ст 121
4) Солі реагують з солями ст. 122.
№1 ст. 119
а) магній карбонат;
б) купрум(ІІ) хлорид;
в) купрум(І) хлорид;
г) натрій ортофосфат;
д) барій нітрат
№6 ст.122
І. 1) Вa + 2H2O = Ba(OH)2 + H2
2) Ba(OH)2+ 2HCl = BaCl2 + 2H2O
3) BaCl2 + Na2CO3 = BaCO3 + 2NaCl
4) BaCO3 + 2HNO3 = Ba(NO3)2 + CO2 + H2O
ll. 1) Zn + H2SO4 = ZnSO4 + H2
2) ZnSO4 + 2HCl = ZnCl2 + H2SO4
3) ZnCl2 + 2NaOH = Zn(OH)2 + 2NaCl
4) Zn(OH)2 + 2NaOH = Na2(Zn(OH)4)
Домашнє завдання: опрацювати параграфи 31, 32, виконати №5 ст. 122
24.04
Контроль знань
1. Установіть відповідність між формулою та класом сполук
А) К2O 1. Кислота
Б) НPO3 2. Основа
В) Cu(OH)2 3. Сіль
Г) KCI 4. Основний оксид
Д) SО2 5. Кислотний оксид
2. Допишіть рівняння можливих реакцій:
А) CaCI2 + KOH→
Б) BaO + H2O→
В)Cu + H2O→
Г) SO2 + H2O→
3. Здійснити перетворення:
Ba→BaO→Ba(OH)2→BaCI2
4. Для нейтралізації хлоридної кислоти кількістю речовини 1,5 моль необхідно взяти кальцій гідроксид масою:
17.04
Розв'язування розрахункових задач
Розглянемо конкретні приклади ст. 98-100.
Опрацьвуємо алгоритм розв'язування розрахункових задач ст. 101.
Домашнє завдання: опрацювати параграф 26, виконати №3 ст. 102
13.04
Хімічні властивості кислот: взаємодія з основними оксидами, основами, солями.
Кислоти взаємодіють з основними оксидами (див ст.111)
Реакції обміну - це реакції між двома складними речовинами, у процесі яких вони обмінюються своїми складовими, утворюючи дві нові складні речовини.
Кислоти взаємодіють з основами, утворюючи сіль та воду (див. ст. 112)
Опрацьвуємо висновки на ст. 112
Виконуємо №8 ст. 113
ZnO + 2HCI = ZnCI2 + H2O
3Mg + 2H3PO4 = Mg3(PO4)2 + 3H2
Cu + HCI =реакція не проходить
K2O + 2HNO3 = 2KNO3 + H2O
Fe2O3 + 6HCI = 2FeCI3 + 3H2O
2Al + 3H2SO4 = AI2(SO4)3 + 3H2
Домашнє завдання: опрацювати параграф 29, доробити №8 ст 113
10.04
Хімічні властивості кислот: дія на індикатори, взаємодія з металами. Ряд активності металів.
1. Кислоти діють на індикатори.
Лакмус - червоне забарвлення, метилоранж - рожево-червоне, фенолфталеїн - безбарвне.
Речовини, які змінюють своє забарвлення внаслідок діїкислот( або лугів), називають індикаторами.
2. Кислоти взаємодіють з металами.
Див. ст.111
Реакції заміщення - хімічні реакції, що відбуваються між простими і складними речовинами, у процесі яких атоми простої речовини заміщують атоми одного з елементів у складній речовині, утворюючи нову просту і нову складну речовини.
Метали за активністю заміщення Гідрогену в кислоті можна розмістити в ряд: ст.111. Метали, які стоять ліворуч від водню, здатні витісняти його з кислоти, а ті, які стоять праворуч від водню, -ні.
Завдання 1. Дописати рівняння реакцій
1) 3Mg + 2H3PO4 = Mg3(PO4)2 + 3H2
2) 2Na + 2HCI = 2NaCI +H2
3) Fe + H2SO4 = FeSO4 + H2
4) Cu + HCI = реакція не проходить, оскільки Купрум стоїть праворуч від водню.
№ 2 ст 113
Zn + HCI = ZnCI2 + H2
Ag + HCI =срібло не витісняє водень
Домашнє завдання: опрацювати параграф 29, виконати №3 ст. 113
06.04
Кислоти. Поширення у природі.
Опрацьовуємо у підручнику ст.109-110.
03.04
Кислоти: склад і назви, класифікація.
У формулах кислот на першому місці стоїть символ Гідрогену, а далі – атом або група атомів, що називається кислотним залишком.
Кислоти – складні речовини, що містять у своєму складі Гідроген та кислотний залишок.
Наприклад, у НСI кислотний залишок – СІ.
Валентність кислотних залишків дорівнює числу атомів Гідрогену в молекулі кислоти.
H2SO4 – валентність залишку SO4 дорівнює 2.
| Формула кислоти | Хімічна назва |
| HCI | Хлоридна |
| HBr | Бромідна |
| HI | Йодидна |
| HF | Флуоридна |
| HNO3 | Нітратна |
| HNO2
| Нітритна |
| H2S | Сульфідна |
| H2SO3 | Сульфітна |
| H2SO4 | Сульфатна |
| H2CO3 | Карбонатна |
| H2SiO3 | Силікатна |
| HPO3 | Метафосфатна |
| H3PO4 | Ортофосфатна |
Класифікація кислот:
А) за основністю (кількістю атомів Гідрогену) на одноосновні (HCI, HI, HNO3…), двохосновні (H2S, H2CO3), трьохосновні (H3PO4);
Б) за складом на оксигенвмісні, що містять Оксиген (H2SO4, H3PO4) та безоксигенові (HF, HCI).
Виконуємо завдання «Вилучи зайве»
- HCI, HNO3, К2SO4, H2S
Зайвим буде К2SO4 оскільки не є кислотою
- H2S, HI, HNO3, HBr
Зайвою є HNO3 оскільки вона є оксигенвмісною кислотою, а інші безоксигенові
- H3PO4, H2SO4, H2CO3, H2SiO3
Зайва H3PO4 , тому що вона трьохосновна, а решта двохосновні кислоти.
Домашнє завдання : опрацювати §28, вивчити формули та назви кислот.
Хімічні властивості амфотерних гідроксидів
Амфоте́рність — здатність сполук проявляти кислотні й основні властивості. Амфотерними сполуками (їх ще називають амфолітами) є вода, гідроксиди алюмінію, цинку, хрому тощо.
-
Zn(OH)2 + H2SO4 = ZnSO4 + 2H2O
-
H2ZnO2 + 2NaOH = Na2ZnO2 + 2H2O
1) 2Zn + O2= 2ZnO
2) ZnO + 2HNO3 = Zn(NO3)2 + H2O
3) Zn(NO3)2+2 NaOH = Zn(OH)2 + 2NaNO3
4) Zn(OH)2 + 2NaOH = Na2ZnO2 + 2H2O
Домашнє завдання: опрацювати параграф 30.
Хімічні властивості нерозчинних основ: взаємодія з кислотами і розкладання внаслідок нагрівання.
Пригадаймо властивості онов, які ми розглядали на попередньому уроці. А саме, властивості нерозчинних основ.
Нерозчинні основи не діють на індикатори, реакції з кислотними оксидами для них не характерні, під час нагрівання розкладаються на відповідний оксид і воду, взаємодіють з кислотами, утворюючи сіль та воду.
Складаємо рівняння реакцій:
1) Mg(OH)2 = MgO + H2O
2) Ba(OH)2 + H2SO3 = BaSO3 + 2H2O
3) 2Fe(OH)3 = Fe2O3 + 3H2O
4) AI(OH)3 + 3HCI =AICI3 +3 H2O
Домашнє завдання: знайти помилку у рівняннях реакції та виправити їх.
СаOH + HCI = CaCI2 + H2O
2Fe(OH)2 = Fe2O3 + 3H2O
Хімічні властивості лугів: дія на індикатори, взаємодія з кислотами, кислотними оксидами, солями.
I. Організація класу
II. Актуалізація опорних знань, мотивація навчальної діяльності
• Який клас неорганічних сполук називається основами?
• На які дві групи поділяються основи? (Розчинні (луги) й нерозчинні (малорозчинні))
IІІ. Вивчення нового матеріалу
1. Дія лугів на індикатори
Акуратно в перший ряд капаємо по дві краплі натрій гідроксиду, у другий ряд — по дві краплі кальцій гідроксиду. Далі в перше заглиблення з кислотами додаємо одну краплю метилового оранжевого, у друге — одну краплю лакмусу, у третє — одну краплю фенолфталеїну.
На основі спостережень заповнюємо таблицю.
https://www.youtube.com/watch?v=VVuHg6hP5t8
|
| Метиловий оранжевий | Лакмус | Фенолфталеїн |
| Нейтральний | Оранжевий | Фіолетовий | Безбарвний |
| NaOH | Жовтий | Синій | Малиновий |
| Са(ОН)2 | Жовтий | Синій | Малиновий |
Висновок. У розчинах лугів метиловий оранжевий набуває жовтого забарвлення, лакмус — синього, фенолфталеїн — малинового. Отже, розчини лугів можна визначити з допомогою індикатора.
2. Взаємодія лугів з кислотними оксидами.
Записуємо рівняння реакції:
СO2 + Са(ОН)2 СаСO3 + Н2O
Укажіть тип реакції. (Реакція обміну)
https://www.youtube.com/watch?v=9OFZHf8WFy0
3. Взаємодія лугів з кислотами
• Як називається ця реакція? (Нейтралізації)
• Яка речовина допоможе побачити, що реакція відбулася? (Індикатор) У дві пробірки наливаємо NaOH і Са(ОН)2, додаємо фенолфталеїн.
А потім по краплях знебарвлюємо розчин хлоридною кислотою.
https://www.youtube.com/watch?v=zVjTNZ8mIts
ІV. Закріплення вивченого матеріалу
Завдання 1. Здійснити перетворення №5 ст. 107
1) 2Са + О2=2СаО
2) СаО + Н2О = Са(ОН)2
3) Са(ОН)2 + 2НNO3 = Ca(NO3)2 + 2H2O
V. Домашнє завдання
Опрацювати параграф 27.
Тема: Основи, їх склад і назви, класифікація, фізичні властивості. Поширеність у природі.
- Повторення.
Прийом «Вилучи зайве»
- СаО, МgO, CO2, Na2O
- SO2, CO2, NO2, K2O
- CO, BaO, Al2O3, HCI
- Вивчення нового матеріалу.
Основами називають сполуки, що складаються з йона металічного елемента і гідроксогруп ОН.
Загальна формула гідроксиду Ме(ОН)n, де Ме – металічний елемент, ОН – гідроксильна група, n – валентність металу.
Число гідроксильних груп в основі визначається валентністю металічного елемента.
Назва основ складається з назви металічного елемента та слова гідроксид. Наприклад, NaOH – натрій гідроксид.
Якщо, валентність металу змінна , то вона вказується в дужках римською цифрою після назви металічного елемента. Наприклад, Fe(OH)2 - ферум(ІІ) гідроксид, Cu(OH)2 – купрум(ІІ) гідроксид.
Класифікація основ та фізичні властивості див. ст. 103-104.
- Закріплення вивченого матеріалу.
Назвіть гідроксиди: КОН, Ва(ОН)2, СuOH, Mg(OH)2, Fe(OH)3
( калій гідроксид, барій гідроксид, купрум(І) гідроксид, магній гідроксид, ферум(ІІІ) гідроксид)
- Домашнє завдання.
Опрацювати §27, виконати №6 ст. 107.












