7 клас
Вчитель хімії: Янкович Оксана Олександрівна моб. 0955011502
05.04
Вода, склад її молекули, поширеність у природі, фізичні властивості. Вода розчинник.
Переглянь те відео - урок за посиланням:
Домашнє завдання
Опрацюйте параграф 25. Виконати впр. 186,187 стр.150.
29.03
Узагальнення " Кисень"
Виконані роботи надіслати до 01.04 на viber
Рівень 1
1. Виберіть лабораторні способи одержання кисню:
А) розклад гідроген пероксиду;
Б) розклад калій перманганату;
В) розклад калій хлорату;
Г) усі відповіді правильні.
2. Оберіть прізвище вченого, якого вважають першовідкривачем кисню:
А) Дж. Дальтон;
Б) Г. Кавендіш;
В) Дж. Прістлі;
Г) А. Лавузьє.
3. Вкажіть букву, під якою наведено формули оксидів:
А) H2O, Li 2O, NaOH;
Б) Li 2O, LiCl, Cl 2O7;
В) CO, CO2, CuO;
Г) NH3, CO2, K 2O.
4. Вкажіть ознаку наявності кисню в посудині:
А) жевріюча скіпка гасне;
Б) скіпка горить та призводить до вибуху;
В) жевріюча скіпка призводить до вибуху;
Г) жевріюча скіпка спалахує.
5.Установіть відповідність
1) Кисень збирають витискуванням повітря, тому що…
2) Кисень збирають витискуванням води, тому що…
а) Кисень легший за повітря
б) Кисень – газувата речовина
в) Кисень – важчий за повітря
г) Кисень розчинний у воді
д) Кисень малорозчинний у воді
Рівень 2
6. Складіть формули оксидів: Хлору (ІІІ), Феруму (ІІІ), Натрію, Кальцію.
7. Складіть рівняння реакцій:
А) Р + O 2→
Б) C2H2 +O 2→
В) Са + О 2→
Рівень 3
8. Складіть рівняння взаємодії кисню з металами залізом і цинком.
9. Яка масова частка Оксигену в СrO3 ?
Рівень 4.
10. Хімічна реакція, під час якої відбувається окиснення речовин з виділенням теплоти та світла, називається…? Наведіть приклади таких реакцій. У чому користь та шкода таких реакцій?
І Домашнє завдання. Складіть 5 питань за темою «Оксиген.Кисень».
22.03
Колообіг Оксигену у природі. Озон. Проблема чистого повітря. Застосування кисню його біологічна роль.
Переглянути відео- урок за посиланням:
Домашнє завдання
Підготуватись до контрольної роботи повторити параграфи 18- 24.
15.03
Взаємодія кисню зі складними речовинами (повне окиснення метану, гідроген сульфіду, глюкози).
22.02
Тема: Поняття про оксиди, окиснення (горіння, повільне окиснення, дихання). Умови виникнення та припинення горіння.
Мета: Вивчити умови виникнення та припинення горіння, з'ясувати галузі застосування кисню; виховувати обережність під час використання вогню.
Хід уроку
Проста речовина кисень підтримує горіння. Кисню, що міститься в повітрі, досить для горіння дров у багатті, природного газу в грубці, вугілля в каміні. Якщо використовувати для горіння чистий кисень, воно відбувається інтенсивніше.
- Взаємодія речовин з киснем не завжди супроводжується горінням. Більшість таких реакцій відбувається непомітно:
- скисання молока
- ржавіння заліза
- гниття
Речовина, взаємодіючи з киснем, зазнає окислення, тобто змінюється за участю кисню. (Такі реакції називаються реакціями окиснення).
Запис в зошит
Окиснення – це хімічна реакція взаємодії речовин (простих і складних), з киснем.
![]()
Повільним окисненням речовин зумовлено ржавіння заліза, скисання молока, фруктових і ягідних соків, прогорання масла, псування багатьох інших продуктів харчування.
Кисень, потрапляючи через легені в організм людини, окиснює різні сполуки, в тому числі й ті, які постійно входять із їжею.
Дихання – приклад життєво необхідного повільного окиснення в живій природі.
Горіння – це хімічна реакція, за якої відбувається окиснення речовин з виділенням тепла і світла. У більшості випадків у результаті цих реакцій утворюються оксиди.
Оксиди – це складні речовини, що складаються з двох елементів, один з яких – Оксиген з валентністю II.
Загальна формула оксидів ЕnOm.
Найпоширенішим оксидом на нашій планеті є звичайна вода!
2Н2 + О2 → 2Н2О
Кожний оксид має хімічну назву, а деякі ще й традиційні, або тривіальні назви. Хімічна назва оксиду складається із двох слів. Першим словом є назва відповідного елемента, а другим словом – «оксид». Якщо елемент має змінну валентність, то він може утворювати кілька оксидів. Їх назви мають відрізнятися. Для цього після назви елемента вказують (без відступу) римською цифрою в дужках значення його валентності в оксиді. Приклад: купрум(ІІ) оксид (читається «купрум-два-аксид»). Оксиди в яких елемент має найбільшу валентність (відповідає номеру групи) називаються вищими.
Напишіть рівняння реакцій та дайте назви оксидам:
Li + O2 →
N2 + O2 →
Ca + O2 →
С + O2 →
АІ + O2 →
N2 + O2 →
Складіть формули оксидів:
Хлор(ІІ) оксид
натрій оксид
фосфор(ІІІ) оксид
магній оксид
Сульфур(VI) оксид
Домашнє завдання : опрацювати параграф 24, Скласти схему «Умови виникнення та припинення горіння»
22.02
15.02
Тема: Хімічні властивості кисню: взаємодія з простими речовинами
( вуглець, водень сірка , магній, залізо, мідь). Реакція сполучення
Повторення
Дайте відповіді на питання (усно)
Які властивості речовин називаються хімічними?
Як можна довести наявність кисню?
Які способи одержання кисню в промисловості вам відомі?
Що необхідно для горіння речовин
Вивчення нового матеріалу
Загальна характеристика хімічних властивостей кисню
Хімічні властивості речовини - це здатність вступати в хімічні реакції з іншими речовинами.
Кисень - одна із найактивніших речовин. Із простих речовин він поступається лише фтору.
Ви вже знаєте, що кисень підтримує дихання і горіння. У чистому кисні яскраво спалахує тліюча скіпка і можуть займатися деякі речовини (бензин, спирт, мастило).
При взаємодії з киснем утворюються оксиди.
Оксиди - це бінарні сполуки з Оксигеном, де валентність Оксигену - ІІ.
Бінарні сполуки - це сполуки, що складаються з двох елементів.
Реакції взаємодії з киснем називаються реакціями окисненням.
Взаємодія кисню з простими речовинами
Швидкий процес окиснення речовини, що супроводжується виділенням великої кількості теплоти, і здебільшого світла, називають горінням.
Кисень взаємодіє з металами та неметалами.
Із неметалів він взаємодіє:
- з вугіллям С +О2 =СО2– карбон (IV) оксид
- з сіркою S+ O2= SO2 – сульфур (IV) оксид
- з фосфором 4P + 5O2 = 2P2O5- фосфор ( V) оксид
Із металів кисень взаємодіє:
- з залізом 4Fe + 3O2 = 2Fe2O3 - ферум ( ІІІ) оксид
- з магнієм 2Мg +O2= 2MgO – магній оксид
- з міддю 2Cu+ O2=2CuO- купрум (II) оксид
- з платиною та золотом кисень не взаємодіє.
Назва оксиду= назва елемента( валентність) + «оксид»
А ще всі хімічні реакції належать до одного типу –реакції сполучення. А ще,всіхімічніреакції належать до одного типу – реакції сполучення.
Реакції сполучення– це реакції між двома простими речовинами, в результаті яких утворюється одна нова складна речовина.
A + B = AB.
Приклади реакцій сполучення
2SO2 + O2 = 2SO3;
2CO + O2 = 2CO2.
S + O2 = SO2;
2Mg + O2 = 2MgO;
C + O2 = CO2.
Узагальнення
Виконайте завдання ( в зошит)
1.Укажіть оксиди й назвітьїх: BaO, CaS, NaCl, Na2O, CO, H2SO4, AgCl, NO2, H3PO4, ZnO.
2.Напишітьрівнянняхімічнихреакційотриманнянаведенихоксидівізпростихречовин: MgO, Al2O3, P2O5, K2O.
Домашнє завдання :
Опрацювати та законспектувати параграф 24.
Виконати завдання 177, 181 ст. 152.
18.01. 2021
Тема. Оксиген. Поширеність Оксигену вприроді.
Повторення
Дайте відповіді на питання ( усно)
1.Що таке хімічний елемент?
2.Що таке речовина?
3.Які речовини називаються простими?
4.Які речовини називаються складними?
5.На які дві групи можна умовно поділити всі хімічні елементи?
Хімічний диктант ( в зошит)
1. Який вчений та в якому році визначив об’ємні частки кисню та азоту в повітрі?
2. Повітря – це…
3. Встановіть відповідність між компонентам повітря та їх об’ємними частками:
| А. 78% | 1. Кисень О2 | |
| Б. 0,04% | 2. Карбон (IV) оксид СО2 | |
|
| 3. Інші гази | |
| Г. 0,03% | 4. Аргон Ar | |
| Д. 0,93% | 5.Азот N2 |
Вивчення нового матеріалу.
Поширеність Оксигену і кисню в природі.
Оксиген. Хімічний елемент Оксиген можна з повним правом назвати всюдисущим. Чому ж? Спробуємо розібратися. Якби ми вигукнули : «Оксиген!», ехо пішло б звідусіль: з – під землі, бо пісок, глина, багато гірських порід і мінералів містять Оксиген; з морів та річок, бо він входить до складу молекули води; з повітря ( чому?), бо 1/5 об’єму повітря – це проста речовина кисень, молекула якої утворена двома атомами Оксигену. Навіть у живих організмах багато Оксигену.
Я скрізь навколо тебе є,
бо Оксиген – ім’я моє.
Я у деревах, у траві,
в твоїх я жилах, у крові.
Характеристика хімічного елемента Оксигену ( в зошит)
1. Назва елемента - Оксиген;
2. Символ елемента - О;
3. Порядковий номер 8;
4. Положення у ПС: 2 период, VI група;
5. Відносна атомна маса Оксигену: Ar (O) ═16;
6. Неметалевий елемент;
7. Валентність в з'єднаннях - ІІ;
8. Утворює три простих речовини: кисень, озон, тетраоксіген;
9. Формули простих речовин: О2, О3, О4;
10. Відносна молекулярна маса: Мr (О2) = 32; Мr (О3) = 48, Мr (О4) = 64.
Оксиген у природі
На поверхні нашої планети Оксиген – найпоширеніший елемент. Він становить 49% від маси земної кори. Вода – найпоширеніша сполука Оксисену. Гідросфера містить 86-89% Оксисену за масою. Як нам уже відомо у атмосфері цього елементу 21%. Живі організми також містять велику кількість Оксисену приблизно 60-62%.
По активності у природі Оксиген посідає друге місце після Флуору. Через це він утворює сполуки майже з усіма елементами.
Про роль кисню в природі написані тисячі книг. Усі живі організми дихають киснем і в безкисневій атмосфері просто не можливе життя. Лише деякі мікроорганізми – анаеробні бактерії, живуть без кисню. Без кисню неможливий процес горіння.
Запитання до учнів:
Згадайте з уроків біології,природознавства, завдяки якому процесу кисень відновлюється в атмосфері? (процес фотосинтезу)
6 СО2 + 6 Н2О → С6Н12О6 + 6 О2
Оксиген утворює дві прості речовини: кисень (О2) та озон (О3).
Оксиди - це бінарні сполуки хімічних елементів з оксисеном.
Оксидів дуже багато. Як іх називають? Назва оксиду складається з двох слів: назва хімічного елемента та слова «оксид». Наприклад
СаО – кальцій оксид. ZnO – цинк оксид. А якщо оксид утворюєть елементом який має змінну валентність, то потрібно післі назви елемента зазначати його валентність.
CuO -купрум(ІІ) оксид; Cu2O - купрум(І) оксид.
Усіживіорганізмидихають киснем і в безкисневійатмосфері просто не можливежиття. Лише деякімікроорганізми – анаеробнібактерії, живуть без кисню.
Графічна формула кисню має такий вигляд: О = О.
Чи знаєте ви, чому при подорожі високо в горах стає важче дихати? Бо найбільше кисню міститься в нижніх шарах атмосфери.
Узагальнення
.Оксиген міститься у мінералах: гематиті Fe2O3, кварці SiO2, піролюзиті MnO2. У яких з них масова частка ( W) Оксисену найбільша?
VІІ. Домашнє завдання.
Опрацювати параграф 22, скласти опорний конспект, виконати впр. 155, 159 стр. 137.
12.11
Тема. Метали й неметали. Металічні та неметалічні елементи, їх розміщення в періодичній системі.
Базовіпоняття і терміни: метали, неметали.
Хід уроку
Актуалізація опорних знань.
(Самостійна робота)
1. Запишіть за допомогою хімічних символів і цифр:
- Дві молекули водню, що складаються з двох атомів Гідрогену_________
- Молекулу озону, яка складається з трьох атомів Оксигену____________
- Три молекули азоту, що складаються з двох атомів Нітрогену_________
- Молекулу сірки, яка складається з восьми атомів Сульфуру___________
2.Що означаютьтакі записи:
a) 2Н _________________________________________________________
b) Н2SO4 ______________________________________________________
c) 4СО2 _______________________________________________________
d) 3O2________________________________________________________
e) 2H2O________________________________________________________
f) 3O__________________________________________________________
g) 5Сu_________________________________________________________
h) N2_________________________________________________________
Вивчення нового матеріалу.
1.Характеристика металів.
За стандартних умов усі метали (за винятком ртуті) є твердими речовинами. Золото та мідь мають характерне забарвлення.
Більшість металів мають сріблясто-білий або сріблясто-сірий колір. Характерний блиск металів спостерігають зазвичай тільки в тому випадку, коли метал утворить суцільну компактну масу. Що правда, магній і алюміній зберігають свій блиск навіть у порошкоподібному стані. Решта тонко подрібнених металів мають чорний або темно-сірий колір. Усі метали – добрі провідники електричного струму. Найліпшими провідниками електричного струму є срібло, мідь і алюміній. Германій – напівпровідник. Метали переважно пластичні. Більшість із них можна кувати, витягати в дріт, прокочувати тощо. Золото – найпластичніший метал, з нього виробляють тонку фольгу. Стибій – навпаки, дуже крихкий. Різняться метали і своєю твердістю. Натрій легко різати ножем. Натомість хром і вольфрам – надзвичайно тверді метали. До того ж вольфрам – найтугоплавкіший із металів. Тому з нього виготовляють спіралі ламп розжарювання. Ртуть має найнижчу температуру плавлення поміж металів. Густина ртуті досить велика. Також до важких металів відносять цинк, залізо, мідь, свинець, золото. Найважчий метал – осмій. Його густина становить 22,6 г/см3. Найлегшим поміж металів є літій. Його густина 0,534 г/см3.
2.Характеристика неметалів. Немета́ли — прості речовини, які не мають властивостей металів, а саме: металічного блиску, непридатні для кування, погано проводять тепло, електричний струм.
До неметалів зараховують 22 хімічних елементи:Гідроген, Азот, Арсен, Силіцій, Оксиген, Флуор, Хлор, Бром, Карбон, Фосфор, Сульфур, Селен, Йод, Астат, Телур, Бор, інертні гази, які складаються з окремих атомів це -Гелій, Неон, Аргон, Криптон, Ксенон і Радон. У графіті, алмазі, силіції, борі, червонному фосфорі всі атоми сполучені один з одним. Водень, азот, кисень, фтор, хлор, бром, йод мають двох атомні молекули.
3.Розміщення металів і неметалів в періодичній системі хімічних елементів. Переважнабільшістьхімічнихелементів, представлених у періодичній системі, є металічними. Усі елементи (від 5 до 85), розташовані лівіше від уявної лінії, проведеної від Бору до Астату, відносять до металічних. Їхні прості речовини – типові метали – натрій, магній, залізо, мідь тощо. Переважно неметалічними є елементи, розміщені правіше цієї межі. Типові неметалічні елементи – Сульфур, Фосфор, Бром та інші. Вони утворюють прості речовини-неметали – сірку, фосфор і бром відповідно. Неметалічний характер елементів і хімічна активність неметалів посилюються в періодах з ліва направо, а в головних підгрупах — знизу догори.
Узагальнення
- Завдання в колбі.( поділити ресовини які знаходяться в колбі)
-
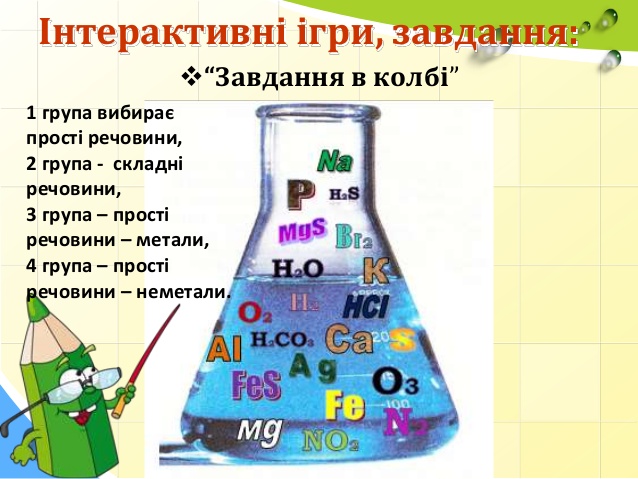
| Прості реч. | Складні реч. | Прості реч.метали | Прості реч.-неметали |
|
|
|
|
|
(Міні-тест)
1. Зазначте, які фізичні властивості характерні для металів:
А тверді речовини, або гази;
Б добре проводять електричний струм;
В витягуються в дріт; Г крихкі; Ґковкі.
2. Зазначте серед наведених речовин метали і неметали:
Al, O, H, Cl, Zn, Fe, Mg, Cu, S, C, F, Na, K, Au.
3. Виберіть серед наведених речовин:
А прості речовини: (вкажіть метали і неметали)
Б Складні речовини:
1. Al2O3; 2. H2; 3. Cl2; 4. Zn; 5.HCl; 6. Fe; 7. Fe3O3; 8.Mg.
VІІ.Домашнєзавдання.
Опрацювати §_13, конпект. Вправа 90 стр.84.
09.11
Тема уроку : Хімічні формули речовин. Прості та складні речовини. Багатоманітність речовин.
Актуалізація опорних знань
«Так чи ні»
Відповісти «так» або «ні» ( в зошит)
- Матеріал - речовина, яку використовують для виробництва інших хімічних речовин
- Властивості речовини це певні ознаки, за якими речовини або відрізняються, або схожі одне з одним.
- Властивості бувають лише фізичні.
- Запах, розчинність у воді, блиск, температура плавлення – це фізичні властивості
- Вода може існувати лише у двох агрегатних станах: рідкий та газуватий.
- Чиста речовина індивідуальна та не містить домішок інших речовин
- Суміші бувають лише однорідними
- Молекула – найменша частинка речовини, що має її основні хімічні властивості та може існувати самостійно
- Атом – найдрібніша частинка речовини, що складається з позитивно зарядженого ядра та негативно зарядженої електронної оболонки
- Атом, що має заряд, називається йоніт
- Хімічній елемент – вид атому з певним зарядом ядра.
- Заряд ядра чисельно дорівнюється відносній атомній масі
Усі відомі нині речовини, а їх вже понад 20 000 000 утворені атомами різних хімічних елементів. Серед такої великої кількості речовин потрібна якась класифікація. Я наведу вам тільки декілька: прості та складні, органічні та неорганічні, метали та неметали. Та вважаю, що ви самі можете визначити та класифікувати речовини за певними ознаками. Спробуємо?
Вивчення нового матеріалу.
Дивитись відео - урок : https://www.youtube.com/watch?v=Xws7zi85cYs
Серед наведених ілюстрацій прошу вас визначити прості та складні речовини та обґрунтувати свій вибір.
Проста речовина - хімічна сполука, утворена атомами ОДНОГО хімічного елементу.
Складна речовина – хімічна сполука, утворена атомами РІЗНИХ хімічних елементів
Проста речовина має формулу О3. Відповідь виводиться на екран без ключових слів:
О3: Три - це ІНДЕКС, вказує на кількість АТОМІВ оксигену в молекулі озону.
А якщо змінити надпис на 2О3, то що означає цифра 2?
2О3 : Два – КОЕФІЦІЄНТ, вказує на кількість МОЛЕКУЛ озону.
Ще одна речовина, з якою кожен день має справу людство. Прошу вас переглянути дослід
«Увага, вода»
Формула води Н2О, вода – складна речовина, до її кількісного складу входять 2 атоми гідрогену та 1 атом оксигену, якісний склад – атоми гідрогену та атоми оксигену, об’єм газу у одній пробірці у два рази менше тому, що у цій пробірці виділявся кисень, а його лише один атом у молекулі води, тоді як гідрогену в два рази більше атомів. Цей опит можна віднеси до реакції розкладу.
Зараз відомо понад 20 мільйонів речовин. Хіміки щодня синтезують нові сполуки. Речовини можуть бути простими та складними. До складу простих речовин входять атоми тільки одного елемента. Речовини, молекули яких складаються з атомів різних елементів, пов’язаних між собою постійними співвідношеннями, називають складними речовинами. Складні речовини також називають хімічними сполуками. Наприклад, до складу кисню O2 входять атоми тільки елемента Оксигену. Кисень належить до простих речовин. До складу вуглекислого газу CO2 входять атоми різних елементів: один атом Карбону та два атоми Оксигену. Вуглекислий газ належить до складних речовин.
Дуже важливо розрізняти поняття “хімічний елемент” і “проста речовина”. Наприклад, Карбон як хімічний елемент – це просто вид атомів, який має заряд ядра плюс шість, він може входити до складу простих речовин (графіт, алмаз та ін.) або складних речовин (харчова сода NaHCO3 , крейда CaCO3 . Крім того, необхідно розрізняти поняття “суміш” і “складна речовина”. Речовини, які входять до складу суміші, зберігають свої індивідуальні властивості, тоді як властивості складної речовини суттєво відрізняються від властивостей простих речовин, утворених тими ж самими хімічними елементами.
За своїми властивостями прості речовини поділяються на метали та неметали. Чіткої межі між металами та неметалами не існує. Метали – це ковкі, пластичні речовини, що мають металічний блиск, здатні проводити тепло та електричний струм. Спільні властивості металів пояснюються їх подібною внутрішньою будовою. Їх атоми утворюють особливий тип атомних кристалів, які називаються металічними кристалами. Неметали – це хімічні елементи, які утворюють у вільному стані прості речовини, що не виявляють фізичних властивостей металів. Неметали не мають такої схожості у властивостях, як метали. Наприклад, такі метали як алюміній, залізо, срібло мають сріблясто-білий або сірий колір, металічний блиск. Порівняємо деякі неметали: водень – газ, сірка – тверда речовина, алмаз– дуже міцний, але крихкий.
Для всіх металів характерна немолекулярна будова. Для неметалів найбільш характерна молекулярна будова, але зустрічаються неметали й атомної будови (алмаз та силіцій). У періодичній системі металічних елементів значно більше, ніж неметалічних. Неметалічні елементи переважно розміщені у правій частині періодичної системи.
Прошу висловитися з приводу питання : Чому речовин так багато та вони такі різні? Відповідь прошу починати словами «Тому що..» Учитель на дошці записує висловлювання учнів, узагальнення на слайді 9.
- Атоми з’єднуються у прості та складні речовини
- Окрім речовин існують суміші, до складу яких входять речовини
- Прості речовини поділяються не метали та неметали.
Домашнє завдання.
- Параграф 13,14,15 конспект.
- Вправа 100стр. 92
05.11
Тема. Маса атома. Атомна одиниця маси. Відносна атомна маса хімічних елементів.
.
Базові поняття та терміни: атомна одиниця маси, відносна атомна маса, протони, нейтрони, електрони.
ХІД УРОКУ
Вивчення нового матеріалу
Якщо скористатися звичайними одиницями маси, наприклад грамами, то маса т найлегшого з хімічних елементів – атома Гідрогену становитиме 0,000 000 000 000 000 000 000 001 67 г. Таке число важко прочитати і важко ним користуватися. Тому такі числа заведено записувати у так званому стандартному вигляді, а саме: т=1,67∙ 10-24.
Тому на практиці замість абсолютних мас атомів використовують відносні атомні маси,
порівнюючи маси атомів різних елементів між собою або з певною частиною маси атома іншого елемента. Сьогодні за одиницю порівняння вибрано 1/12 частину маси атома Карбону. Вона називається атомною одиницею маси – а. о. м.
(1 а. о. м.= 1,66 ∙10-27кг = 1,66∙ 10-24 г).
Нині застосовують відносні атомні маси — фізичні величини, що показують, у скільки разів маси атомів хімічних елементів більші за 1/12 маси атома Карбону.
Реальну масу кожного атома розділили на цю величину й одержали відносну атомну масу, що показує, у скільки разів маса атома більша за 1/12 маси атома Карбону.
ІV група
Відносну атомну масу позначають буквою А з індексом r (Аr), де r — перша літера англійського слова relative, що означає «відносний». Відносна атомна маса — це величина безрозмірна. Її одиницею вимірювання є а.о.м.
V група
Отже, у періодичній системі для кожного хімічного елемента зазначено не реальну, а відносну атомну масу.
Значення відносних атомних мас елементів, які використовуються в хімічних розрахунках, округлюються до цілих чисел. Значення мас деяких елементів округлюються до десятих, наприклад у Хлору Аr =35,5
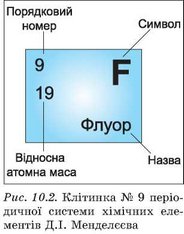
Узагальнення
Заповнення таблиці
| Назва хімічного елемента | Хімічний символ | Порядковий номер | Відносна атомна маса | Заряд ядра атома | Кількість електронів |
|
| Са |
|
|
|
|
| барій |
|
|
|
|
|
|
|
| 16 |
|
|
|
|
|
|
| 56 |
|
|
|
|
|
|
| 30 |
|
|
|
|
|
|
| 13 |
VІ. Домашнє завдання:
• Опрацювати матеріал підручнику параграф 12, конспект.
.
02.11
Періодична система Д. І. Менделєєва. Структура періодичної системи.
Базові поняття й терміни: періодична система хімічних елементів, група, період, ряд.
Повторення
- Хімічний диктант (у зошит)
1. Назва простої речовини Гідрогену − …
2. Символ хімічного елемента Сульфуру …
3. Позитивні і негативні бувають …
4. Вид атома з певним зарядом ядра …
5. Назва простої речовини Карбону − …
6. Заряд ядра завжди …
7. Атом не має ....
8. Хімічний знак елемента Фосфору …
9. Атом складається з позитивного зарядженого ядра та …
10. Оксиген утворює просту речовину …
11. Протони мають заряд …
12. Електрони мають заряд …
Вивчення нового матеріалу
Перші спроби класифікації хімічних елементів
| Я. Берцеліус | Й.Деберейнер | Л. Мейер | Дж.Ньюлендс |
| Розподілив елементи на метали й неметали | Розподілив елементи за валентністю | Один з перших, хто запропонував періодичну систему елементів.Склав таблицю, де було розміщено 28 елементів у шість рядів згідно з їхньої валентністю. | Розташував хімічні елементи за порядком збільшення атомної маси по 8 елементів. |
Дмитро Іванович Менделєєв розташував елементи в певному порядку – збільшення відносної атомної маси. Періодична система була складена на основі періодичного закону, відкритого в 1869 році Д. І. Менделєєвим. Періодичний закон ми розглянемо трохи пізніше, а до Періодичноїсистеми звертатимемося впродовж усього курсу вивчення хімії. На момент створення Періодичнасистема містила лише 63 елементи — саме стільки їх було відкрито на той час. У міру відкриття нових елементів вона доповнювалася новими даними. На честь Д. І. Менделєєва хіміки називають Періодичну систему його ім’ям. Геніальність Д. І. Менделєєва
полягала в тому, що він передбачив існування невідкритих на той час елементів і залишив для них вільні місця в таблиці.
Сьогодні до Періодичної системи внесено 118 елементів. Вона поповнюється щойно відкритими елементами, і поки що вчені не можуть однозначно стверджувати, скільки всього елементів може існувати.
Структура періодичної системи
Періодична система хімічних елементів має вигляд таблиці. Елементи в ній розташовані в певному порядку — у міру збільшення маси їхніх атомів. Кожний елемент має свій порядковий номер, і цей номер дорівнює заряду ядра атомів цього елемента. Існує багато різновидів зображення Періодичної системи: кругові, спіральні, пірамідальні, із розташуванням елементів зверху вниз і зліва направо. Найбільш загальноприйнятим є зображення у вигляді таблиці з розташуванням елементів зліва направо.
У Періодичній системі всі елементи об’єднані в періоди — горизонтальні ряди елементів, і групи — вертикальні ряди елементів. У довгому варіанті Періодичної системи елементи об’єднані в 7 періодів і 18 груп, а в короткому — також у 7 періодів, але у 8 груп. У нашій країні традиційно користуються короткоперіодним варіантом.
Міжнародне товариство IUPAC* рекомендує для використання довгоперіодний варіант Періодичної системи. Перші три періоди називають малими, оскільки в них міститься невелике число елементів: у першому періоді містяться тільки 2 елементи (Гідроген і Гелій), а в другому і третьому — по 8 елементів. Решту періодів називають великими: у четвертому і п’ятому періодах містяться по 18 елементів, а у шостому і сьомому — по 32 елементи. Групи об’єднують елементи з подібними властивостями. Деякі групи елементів мають назви, наприклад, група лужних елементів або група інертних елементів. У нижній частині таблиці розташовані родини елементів — лантаноїди та актиноїди. Ці елементи розміщені після Лантану (№ 57) й Актинію (№ 89) і формально належать до третьої групи. Проте розміщення цих елементів у таблиці зробило б її громіздкою і незручною, тому їх зазвичай виносять за її межі. Кожний елемент має свою «адресу» в Періодичній системі.
Щоб описати місце елемента в Періодичній системі, треба назвати його порядковий номер, а також номер групи та періоду. Наприклад: елемент Оксиген має порядковий номер 8, розміщений у другому періоді, шостій групі.
Елементи, так само як речовиниабомолекули, маютьпевнівластивості.Найважливіші характеристики елементів, наведені вПеріодичнійсистемі, — це порядковий номер, відноснаатомнамасатощо.
Структура періодичної системи
Дивитись відео : https://www.youtube.com/watch?v=gAuU_G_rtmg
Період – це горизонтальний ряд хімічних елементів, який починається лужним металічним елементом, а закінчується інертним газом.
Група – це вертикальний стовпчик хімічних елементів, які мають однакову вищу валентність.
Узагальнення ( усно)
Завдання: серед наведеного переліку виберіть зайвий елементі поясніть свій вибір.
а). Li, K, Ca, Cs
б). С, Si, Ti, Ge
в). K, Sc, Mn, Cl
Домашнє завдання
Опрацювати параграф, 10, 11 ; виконати завдання № 64 (стор. 71)., короткий конспект.
14.09.2020
Тема уроку: Правила безпеки під час роботи з лабораторним посудом та обладнанням кабінету хімії.
Базові поняття та терміни:техніка безпеки, штатив, спиртівка, газовий пальник, пробірка, пробіркотримач, колба, лійка, мірний циліндр, хімічна склянка.
ХІД УРОКУ
Повторення
Дайте відповіді на питання ( усно)
| 1. До яких наук належить хімія? |
| 2. Дати визначення поняттю хімія. |
| 3. Що вивчає хімія? |
| 4. Яке походження слова хімія? |
| 5. Який вчений дав початок хімії як науки? |
ІІІ. Вивчення нового матеріалу
Хімія – експериментальна наука, тому в процесі її вивчення виконується велика кількість практичних та лабораторних робіт. Багато хімічних дослідів пов’язано з використанням їдких, отруйних та горючих речовин. У зв’язку з цим, потрібно дотримуватися техніки безпеки, щоб запобігти нещасному випадку. Дотримуючись цих правил, ви цим самим збережете життя собі та оточуючим.
Правила техніки безпеки
- Працювати в кабінеті хімії слід обов’язково в халаті, для того, щоб речовини не пролилися випадково на одяг та не зіпсували його.
- Потрібно уважно читати етикетку з речовиною. Відкривши посудину, корок від неї класти треба навпаки.
- Реактиви брати лише в тих кількостях, які зазначені в методиці виконання роботи.
- Надлишок узятого реактиву ні в якому разі не зливати, не зсипати назад у посудину, де він зберігався. Його зливають у спеціальний посуд.
- Наливати розчин треба так, щоб етикетка була спрямована в бік долоні.
- При нагріванні розчинів у пробірці потрібно користуватися дерев’яним тримачем, так щоб отвір пробірки був спрямований у бік від вас.
- Щоб уникнути нагрівання, пробірку потрібно нагрівати всю, а не лише нижню частину.
- Не заглядайте в пробірку, в якій нагрівається рідина, бо непомітні бризки можуть потрапити в очі.
- Ніякі речовини не пробувати на смак.
- Нюхати речовини обережно, спрямовуючи руками пару до себе і не вдихати повними грудьми.
- Якщо розчин лугу потрапив на руки, негайно змийте його великою кількістю проточної води, до зникнення відчуття милкості та нейтралізуйте розчином оцтової кислоти.
- В разі потрапляння не руки концентрованої сульфатної кислоти також змийте великою кількістю води та нейтралізуйте содою.
- Не вживайте їжу в кабінеті хімії.
- У разі нещасного випадку негайно звернутися до вчителя.
Закріплення
Вставте пропущені слова, користуючись довідкою.
а) Для вимірювання об’єму рідини використовується _____ або _____.
б) Випаровування рідини з розчину виконують за допомогою ______ та _______.
в) Для нагрівання в лабораторії використовують ______ або _______.
г) Більшість хімічних дослідів проводять у ______________.
Слова для довідки: - пальник; - мірна колба; - спиртівка; - газовий пальник; - піпетка; - порцелянова чашка; - пробірка.
Домашнє завдання.
- Опрацювати § 3,4
- Намалювати біля написів необхідні зображення лабораторного обладнання та посуду:
1.Лійка
2. Мірний циліндр.
3. Пробірка
21.05
Підсумкова контрольна робота за ІІ семестр
1. Позначте символ хімічного елемента Оксигену:
А О; Б О3; В О2; Г О5.
2. Позначте, де у виразі йдеться про просту речовину, а не про хімічний елемент:
А Оксиген входить до складу води;
Б кисень входить до складу земної кори;
В Оксиген сприяє колообігу інших елементів;
Г Оксиген входить до складу вуглекислого газу.
3. Позначте фізичні властивості кисню за звичайних умов:
А газ без запаху і смаку;
Б кристали синього кольору;
В Добре розчиняється у воді;
Г на кисень припадає трохи більше 1/5 об’єму повітря.
4. Встановіть відповідність:
Формули оксидів: Назви оксидів:
1 Р2О5; А фосфор (ІІІ) оксид;
2 СаО. Б фосфор (V) оксид;
В кальцій оксид.
5. Встановіть відповідність:
Склад розчину: Масова частка розчиненої речовини:
- 95 г води та 5 г солі А 20%
- 9 г води та 1 г солі Б 5%
- 20 г води та 5 г солі В 10%
6. Складіть рівняння реакції взаємодії оксидів з водою.
А) кальцій оксид:
Б) сульфур(VI) оксид:
7. Визначте масу солі, яку необхідно взяти для приготування розчину масою 250 г із масовою часткою солі в ньому 0,15. Відповідь округліть до цілого числа.
18.05
Охорона водойм від забруднення. Очищення води на водоочисних станціях та в домашніх умовах
Очищення води в домашніх умовах.
Дійсно, в домашніх умовах, не застосовуючи спеціальні технічні засоби, можна отримати не просто досить чисту воду, але і що володіє цілющими властивостями.Перша частина цього методу всім добре відома як відстоювання. Воно застосовується для видалення летких компонентів (хлор, сірководень) і осадження важких домішок (карбонат кальцію, деякі важкі метали і ін.). Відстоювання не дає повного розділення речовин, але, принаймні, робить воду чистіше. Найбільший ефект при цьому можна отримати, якщо з водопроводу подається хлорована вода. Для видалення летких компонентів відстоювати воду необхідно не менше двох-трьох годин, а для здобуття осаду важких металів не менше 6 годин.Аби позбавитися від осаду, необхідно злити його в раковину разом з однією третю води. Для цього можна скористатися гнучкою трубкою. Потрібно опустити її до дна, дати можливість рідини здолати верхню точку і зливати її разом з осадом. Процес цей вимагає часу і терпіння, а результат досить сумнівний Абсолютного результату можна досягти за допомогою випаровування і здобуття води, що дистилює. Така вода не містить ні шкідливих, ні корисних домішок. Постійне вживання води, що дистилює, поза сумнівом, шкідливо, оскільки вона вимиває з організму людину солі, у тому числі і корисні.Проте саме цю властивість застосовують при лікуванні деяких захворювань, пов'язаних з надлишком солі в організмі.Очищати воду можна методом часткового заморожування. Річ у тому, що в першу чергу замерзає найбільш прісна і чиста частина води, а після - що містить солі і різні домішки.Для того, щоб виконати цю операцію, беруть воду після відстоювання, наливають її в миску або каструлю і ставлять на аркуш фанери або картону в морозилку. Важливо розрахувати час так, щоб вода замерзала приблизно наполовину. Саме ця частина і буде використана для приготування їжі і пиття. В принципі, це теж метод сепарації, але відбувається він за допомогою зміни структури води.Після цього лід розтоплюють при кімнатній температурі. Тала вода також зазнає структурні зміни, які створюють цілющий ефект.Причому в холодну пору року можна не захаращувати холодильник і не витрачати електроенергію, а скористатися силами природи і заморожувати воду на відкритому повітрі. Тала вода зберігає свої цілющі властивості перший час після відтавання.
Очищення води на водоочисних станціях. Існують різноманітні методи очищення води від забруднень і кожен з них має свої переваги та недоліки. Однозначно визначити найкращий неможливо, поговоримо про кожен з основних методів окремо.Методи очищення води та принципи роботи очисних пристроїв можна умовно розділити на фізико-хімічні, біологічні та механічні.
Домашнє завдання: опрацювати параграф 31
14.05
Проблема чистої води. Кислотні дощі
Розвиток виробництва, збільшення населення потребують великої кількості води. Україна недуже багата на водні ресурси. Тому проблема охорони та раціонального використання водних ресурсів є актуальною для України. Причинами, що призводять до дефіциту прісної води в Україні, є інтенсивне зростання потреби у воді у зв’язку з ростом населення та розвитком галузей виробництва, що потребують великих затрат водних ресурсів, скорочення водоносності рік, яке пов’язано з осушуванням боліт, вирубуванням лісів, розорюванням луків, що призводить до скорочення рівня ґрунтових вод, неекономне використання води, забруднення водойм побутовими стоками.
Чим же забруднюється вода? Дуже токсичними є Меркурій, Кадмій, Плюмбум. Якщо ці речовини та їх сполуки потрапляють із промисловими стоками у водойми, вони призводять до загибелі планктону і молюсків, що беруть участь у самоочищенні води. Солі важких металів зумовлюють порушення нормальних умов розмноження риб, при цьому вони гинуть від прямого отруєння. Найбільш чутливі до важких металів ікра і мальки, ці метали спричиняють захворювання всіх систем організму тварини і людини. Наявність навіть незначної кількості миючих засобів у воді надає їй неприємного запаху і смаку.
| Види забруднення | Приклади |
| 1. Фізичні | Пісок, глина |
| 2. Біологічні | Бактерії, віруси |
| 3. Хімічні | Добрива, отрутохімікати, бензин, машинне масло, нафта, каналізаційні стоки, викиди підприємств |
| 4. Теплові | Тепла вода із заводів, пралень |
| 5. Механічні | Сміття |

Домашнє завдання: опрацювати параграф 30, 31.
07.05
Значення води і водних розчинів у природі та житті людини
Опрацьовуємо параграф 30.
№ 218
а) 2ZnS + 3O2 = 2ZnO + 2SO2
б) 2MoS2 + 7O2 = 2MoO3 + 4SO2
№219
а) N2O3 + H2O = 2HNO2
б) N2O5 + H2O = 2HNO3
04.05
Поняття про індикатори
Речовини, які змінюють забарвлення в розчинах лугів і кислот, називають індикаторами.
Найважливіші індикатори - універсальний, лакмус, фенолфталеїн, метилоранж.
Індикатор у розчині кислоти набуває іншого забарвлення, ніж в розчині лугу.
Див. мал. 83 ст.168
№ 212
а) можна, забарвлення лакмусу у розчині води та кислоти різне;
б) не можна, фенолфталеїн у розчині води і кислоти безбарвний.
Домашнє завдання: опрацювати параграф 29.
27.04, 30.04
Взаємодія води з оксидами. Поняття про гідрати оксидів: кислоти й основи.
Пригадайте, які сполуки називають оксидам, формули та хімічні назви оксидів.
Гідроксиди - сполуки металічних елементів із загальною формулою М(ОН)n. М - металічний елемент, ОН - гідроксидна група, валентність якої 1, n - валентність металу.
К2О + Н2О = 2КОН (калій гідроксид)
Назви гідроксидів складаються з назви хімічного елемента та слова гідроксид, якщо валентність металу змінна, то вона вказується в дужках римськими цифрами.
ВаО + Н2О = Ва(ОН)2 (барій гідрокид)
Більшість гідроксидів не розчиняються у воді, а відповідня оксиди з водою не взаємодіють.
Вода реагує майже з усіма оксидами неметалічних еементів. Продуктами цих реакцій є кислоти.
Рівняння реакції зображені на ст. підпучника 164-165.
№206
а) Li2O + H2O = 2LiOH (основа, літій гідроксид)
SO2 + H2O = H2SO3 (кислота)
б) SrO + H2O = Sr(OH)2 (основа, стронцій гідроксид)
I2O5 + H2O = 2HIO3 (кислота)
№208
Обчислюємо відносну молекулярну масу окиду
Mr(Р2О5) = 2*Ar(Р) + 5*Ar(О) = 2*31 + 5*16 = 62+80 = 142
w(O) = (n*Ar(O)) : Mr(P2O5) = (5*16) : 142 = 80:142 = 0, 5634 або 56,33%
Відповідь: w(O)= 56,33%
Домашнє задання: опрацювати параграф 28, виконати №208 (б).
23.04
Контроль знань
І рівень ( 3 б)
1. Розчинником називають - …
2 .Компонентами розчину є…і … речовина.
3.Найчастіше як розчинник використовують…
ІІ рівень ( 3 б)
4.Перерахуйте фізичні властивості води.
5. Опишіть поширеність води у природі.
ІІІ рівень ( 3 б)
6. Обчисліть та позначте масову частку солі в розчині, якщо у воді масою 57 г розчинили сіль масою 3 г: А. 5,1%. Б. 5%. В.5,4%. Г. 5,2%.
7. Обчисліть та позначте масову частку нітратної кислоти (HNO3) в розчині, якщо у воді масою 25 г. розчинили кислоту масою 2 г:
А. 8,7%. Б. 8,2%. В. 7,4%. Г.8,5%.
ІV рівень ( 3 б)
8. Обчисліть та позначте масову частку натрій нітрату(NaNO3) в розчині, якщо до його розчину масою 130 г з масовою часткою солі 12% долили воду масою 70 г.:
А. 7,6%. Б. 7,5%. В.7,8%. Г. 8%.
16.04
Обчислення масової частки та маси розчиненої речовини в розчині
Актуалізація опорних знань.
1) основна формула:
w(реч.)=m(реч.)/m(р-ну);
2) з основної формули можна вивести наступні:
m(реч.)= w(реч.)* m(р-ну);
3) що пам’ятаємо за густину води? (густина води прийнята за одиницю, тому маса води чисельно дорівнює її об’єму. Густина води становить 1г/мл, тому m(води)=1 г, а v(води)=1мл.)
- Розв’язування задач.
Розв’яжіть задачі:
1. 25г солі заляли 100г води. Визначіть масову частку солі в утвореному розчині.
Дано:
m(солі)=25г
m(води)=100г
Знайти:
w(солі)-?
Розв’язок
1. Визначаємо масу розчину: m(р-ну)= m(води)+ m(солі)=100г+25г=125г
2. Визначаємо масову частку солі в утвореному розчині:
w(солі)=m(солі)/m(р-ну);
w(солі)=25г/125г=0,2 або 20%
Відповідь: масова частка солі в утвореному розчині становить 0,2 або 20%.
2. 15г цукру заляли 100мл води. Визначити масову частку розчиненої речовині в даному розчині.
Об’єм води чисельно дорівнює її масі, тому m(води)=100г.
m(р-ну)=100г+15г=115г;
w(цукру)=15г/115г=0,13 або 13%
Відповідь: 13%.
3. 7г певної речовини розчинили у 34г спирту. Визначіть масову частку розчиненої речовини в розчині.
m(р-ну)=7г+34г=41г;
w(речовину)=7г/41г=0,17 або 17%
Відповідь: 17%.
4. Приготували 40г розчину, де масова частка солі становить 10%. Скільки грам солі і який об’єм води в приготовленому розчині?
1. Визначаємо масу солі в розчині:
m(солі)= w(солі)* m(р-ну);
m(солі)=40г*0,1=4г.
2. Визначаємо масу води в розчині:
m(води)=40г-4г=36г; оскільки маса води чисельно дорівнює її об’єму, то V(води)=36мл.
Відповідь:4г солі і 36мл води.
5. Приготували 74г розчину, де масова частка солі становить 20%. Визначіть масу солі і води в розчині.
m(солі)= 74г*0,2=14,8г;
m(води)= 74г-14,8г=59,2г
Відповідь:14,8г солі і 59,2г води.
6. Приготували 100г розчину, де масова частка солі становить 15%. Визначіть масу солі і води в розчині.
m(солі)= 100г*0,15=15г;
m(води)= 100г-15г=85г
Відповідь:15г солі і 85г води.
Домашнє завдання: повторити параграф 26,27 та розв'язати задачу.
1. 25г солі заляли 100г води. Визначіть масову частку солі в утвореному розчині.
13.04
Практична робота №5. Виготовлення водних розчинів із заданими масовими частками розчинених речовин. Інстуктаж з БЖД.
ст. 158-159
Виконуємо розрахунки, результати разом із вихідними даними записуємо у таблицю.
09.04
Кількісний склад розчину. Масова частка розчиненої речовини. Виготовлення розчину.
Задача 1.Обчисліть масову частку цукру в розчині, який містить 200 г води і 50 г цукру.
Дано:
m (цукру) = 50 г
m (води) = 200 г
Знайти - w (цукру)
Записуємо розрахункову формулу:
w (цукру) = (m (цукру) : m (розчину)) * 100%
Шукаємо масу розчину
m (розчину) = m (цукру) + m (води) = 50 г +200 г = 250 г
Підставляємо
w (цукру) = ( 50 г : 250 г) * 100% = 20%
Відповідь: 20%
Задача 2. Яка маса солі міститься в розчині масою 50 г з масовою часткою речовини 0,25.
Дано:
m (розчину) = 50 г
w (солі) = 0,25
Знайти m (солі)
За формулою для масової частки обчислимо масу речовини. Оскільки в даному випадку масова частка наведена не у відсотках, а в частках від одиниці, то у формулі для обчислення "100%" не наводиться:
m (солі) = m (розчину) * w (солі) = 50 г * 0,25 = 12,5 г
Відповідь: 12,5 г солі
Домашнє завдання: Обчисліть масову частку солі в розчині, який містить 150 г води і 20 г солі.
06.04
Кількісний склад розчину. Масова частка розчиненої речовини. Виготовлення розчину.
Часто виникає необхідність з′ясувати не лише те, які речовини містяться в розчині, а і його кількісний склад.
Пригадайте, які складові розчину (розчинник і розчинена речовина)
Див. мал. 77 та 78 на ст. 155 ви помітили поряд з назвою розчиненої речовини цифру і знак відсотку. Це значення масової частки розчиненої речовини у розчині. Воно відповідає масі речовини ( у грамах), яка міститься у 100 г розчину. Згідно з етикетками на мал. 77 в розчині масою 100 г аміаку міститься 10 г аміаку, а води 100-10=90 г; в розчині перекис водню в 100 г розчину перекису міститься 3 г, а води 100-3=97 г.
Масову частку виражають не лише у відсотках, а й додатнім числом меншим за одиницю. Масову часку обчислюють за формулою, яка подана на ст. 155. Якщо масову часку потрібно отримати у відсотках, використовують формулу на ст. 156.
Масова частка розчиненої речовини у розчині – це відношення маси речовини до маси розчину.
На ст. 156-158 подані розв′язки розв′язування задач, опрацюйте їх.
Виконуємо №195 (усно)
Нам дано масу розчину 300 г, та масову частку 0,02.
Обчислити треба масу розчиненої речовини. Нам треба масу розчину помножити на масову часку 300·0,02=6 г
№196 (усно)
Дано масу розчиненої речовини (цукру) та масу розчинника (води). Шукаємо масу розчину 50 г +200 г = 250 г
Обчислюємо масову частку цукру 50 г : 250 г = 0.2 або 20%
№199
Дано:
m (р-ну) = 2 кг або 2000г
w(р.р.) = 0.9% або 0,009
Знайти – m(р.р.) , m(р-ка)
Обчислюємо масу р.р.
m(р.р.) = w(р.р.) · m (р-ну) = 0.009 ·2000 г = 18 г
Обчислюємо масу води
m(р-ка) = m (р-ну) - m(р.р.) = 2000 г – 18 г = 1982 г
Відповідь: m(р.р.) = 18 г, m(р-ка) = 1982 г
Домашнє завдання: опрацювати §28, виконати №198
02.04
Розчин і його компоненти. Вода як розчинник.
Пригадайте якими бувають суміші (однорідні та неоднорідні). Однорідні відрізняються від неоднорідних тим, що в них рівномірно розподілені найдрібніші частинки. Ці частинки не можна виявити навіть за допомогою мікроскопа.
Однорідні суміші речовин називають розчинами.
Існують не лише рідкі розчини, а й тверді та газуваті (див. мал.76 ст 152)
Розчин містить розчинник та розчинену речовину. За розчинник приймають ту речовину, яка перебуває в такому самому агрегатному стані, що й розчин. Якщо агрегатний стан усіх речовин однаковий, то розчинником вважають речовину, маса якої найбільша. Якщо в розчині є вода, то вона завжди буде розчинником.
Вода – розчинник. (Опрацьовуємо матеріал параграфа на ст 152-153)
Виконуємо №189
а) золота буде розчинником, оскільки його маса більша;
б) розчинник - ацетон, так як має більшу масу;
в) вода, тому що вода завжди розчинник.
№191
Воду використовують як розчинник, тому що вона розчиняє велику кількість твердих, рідких та газуватих речовин.
№192
Так як одним із компонентів суміші є вода (вона розчинник) розчин мав би називатися водним.
Домашнє завдання: опрацювати §26.
30.03
Вода, склад її молекули, поширеність у природі, фізичні властивості. Вода - розчинник.
Оскільки про воду говорять досить часто і в побуті і на уроках, починаючи з початкових класів, продовжіть речення "Про воду я знаю, що..."
Вода - складна речовина, утворена двома елементами - Гідрогеном і Оксигеном. Її хімічна формула Н2О.
Вода належить до оксидів. Графічна формула води та моделі молекули зображені на мал. 72 ст 148.
Вода - одна з найпоширеніших речовин на нашій планеті. Вода вкриває 2/3 поверхні Землі, 97% усієї води знаходиться в морях та океанах. На прісну воду припадає менше 3%. (див. мал.73 ст 148)
Фізичні властивості: за звичайних умов - безбарвна рідина, яка не має запаху та смаку, кипить при температурі 100 градусів Цельсія, замерзає при 0 і має густину 1 г/см3. Лід трохи легший за воду.
Виконуємо №181
Н2О -гідроген оксид
Виконуємо №182
Контактуючи з повітрям, вода розчиняє невеликі кількості його компонентів - кисню, азоту, вуглекислого газу, У ній містяться і часточки пилу, інші розчинні і нерозчинні компоненти.
№186
Відносна атомна маса Оксигену 16, а Гідрогену 2*1.
16:2=8
Маса Оксигену більша у 8 разів.
Домашнє завдання: опрацювати параграф 25.
Контроль знань з теми «Кисень»
1.Яка валентність Оксигена у сполуках?
А) ІІ Б) ІІІ В) ІІ або ІІІ Г) ІІ або І
2. Оксиди – це …
А) речовини, що взаємодіють з киснем;
Б) речовини, що складаються з атомів двох хімічних елементів, один з яких Оксиген;
В) речовини, що складаються з атомів двох хімічних елементів, один з яких Гідроген;
Г) усі складні речовини, у складі яких міститься Оксиген.
3. Для того, щоб загасити предмет, який горить, треба його…
А) охолодити або припинити доступ кисню;
Б) винести на свіже повітря;
В) залити бензином;
Г) нагріти.
4. Які реакції називаються реакціями сполучення?
5. Обчислити відносну молекулярну масу Fe2O3 /
6. Наведіть приклад повільного окиснення.
7. Складіть рівняння хімічних реакцій взаємодії кисню з простими речовинами, у результаті яких утворюються такі оксиди: а) купрум(ІІ) оксид; б) магній оксид; в) фосфор(ІІІ) оксид.
8. Назвіть оксиди: а) AI2O3; б) СО2; в) Nа2О.
9. Запишіть рівняння хімічних реакцій:
HgO →
C + O2→
CO + O2 →
Відповіді надсилати на електронну пошту [email protected] або на вайбер 0992396461.
Озон. Проблема чистого повітря. Застосування кисню, його біологічна роль.
- Перевір себе.
Фотосинтез – джерело атмосферного:
А) вуглекислого газу;
Б) азоту;
В) гелію;
Г) кисню.
Збільшити вміст кисню в повітрі можна завдяки:
А) збільшення кількості зелених насаджень;
Б) розкладанню поживних речовин;
В) зменшенню кількості зелених насаджень;
Г) сприянню процесам дихання.
2. Вивчення нового матеріалу.
У верхніх шарах атмосфери під впливом ультрафіолетових променів сонця озон перетворюється на кисень і додатково збагачує атмосферу киснем. Озон міститься у вигляді «пласта» заввишки 5 км, який називають «озоновим шаром». Поглинаючи ультрафіолетові промені сонця (шкідливі для живих організмів) і перетворюючись при цьому на кисень, озон виконує захисну роль.
Опрацьовуємо ст. 144-145
- Узагальнення та систематизація знань.
1.Виконуємо №179 ст. 146
Обчислюємо молекулярну масу кисню та озону
Mr(O2) = 2·16=32
Mr(O3) = 3·16=48
Молекулярна маса озону більша, обчислюємо у скільки разів
48:32=1.5
Відповідь: молекула озону в 1,5 разів важча за молекулу кисню.
2.Озоновий шар захищає живі організми Землі від:
А) інфрачервоних променів;
Б) сонячної енергії;
В) ультрафіолетових променів;
Г) надлишку кисню.
4. Домашнє завдання.
Опрацювати §24
Тема: Колообіг Оксигену у природі
1. Повторення
Напишіть рівняння реакцій: а) горіння заліза (формула речовини, що утворюється Fe3O); б) горіння етилового спирту С2Н5ОН.
2. Вивчення нового матеріалу.
Сукупність процесів у природі, під час яких атоми елемента внаслідок хімічних реакцій переходять від одних речовин до інших, називають колообігом елемента.
Колообіг Оксигену включає наступні процеси:
- витрати кисню (на окиснення речовин у природі та побуті, дихання, витрати під час горіння);
- утворення кисню (наприклад, у процесі фотосинтезу);
- взаємоперетворення оксигеновмісних сполук.
Фотосинтез — це складний процес, який відбувається у зелених листках рослин на сонячному світлі. У результаті з вуглекислого газу CO2 і води H2O утворюються органічні речовини і виділяється кисень.
Реакція фотосинтезу:
Вільний кисень нашої планети утворився і зберігається завдяки процесу фотосинтезу:
6CO2+6H2O=світло, хлорофілC6H12O6+6O2.
Процеси дихання, гниття і горіння діють в протилежному напрямку і переводять атмосферний кисень в вуглекислий газ і воду:
C6H12O6+6O2=6CO2+6H2O.
У результаті протікання протилежних процесів кисень знаходиться в постійному
круговороті.
Кисень — найпоширеніший хімічний елемент на Землі. У земній корі його масова частка складає 49,5 %. Кисень входить до складу води, різних мінералів, гірських порід, глини, піску, органічних сполук. Міститься у всіх живих організмах. У вигляді простої речовини кисень знаходиться у повітрі, в якому його об'ємна частка становить 21 %, а масова — 23 %.
Вільний кисень нашої планети утворився і зберігається завдяки процесу фотосинтезу:
6CO2+6H2O−→−−−−−−−−світло,хлорофілC6H12O6+6O2−Q.
Процеси дихання, гниття і горіння діють в протилежному напрямку і переводять атмосферний кисень у вуглекислий газ і воду:
C6H12O6+6O2→6CO2+6H2O+Q.
Вуглекислий газ і вода утворюються також внаслідок викидів заводі, підприємств, фабрик, горіння палива.
Вуглекислий газ і вода поглинаються зеленими листками рослин, і під дією світла, за допомогою хлорофілу, що міститься у хлоропластах, знову утворюються органічні речовини, поповнюючи атмосферу киснем. Таким чином відбувається колообіг Оксигену.
У результаті протікання протилежних процесів кисень знаходиться в постійному колообігу.
Схему колообігу Оксигену і кисню можна зобразити наступним чином:
- витрачання кисню (на процеси дихання, окиснення речовин у природі та під час технологічних процесів, згоряння палива, тощо);
- взаємоперетворення оксигеновмісних сполук;
- утворення кисню (наприклад, у процесі фотосинтезу).
Колообіг Оксигену полягає у переміщенні його атомів між тілами живої і неживої природи. Завдяки колообігу Оксигену у живій природі підтримується вміст кисню у повітрі.
3. Узагальнення та систематизація знань.
- У яких природних процесах бере участь кисень?
4. Завдання: опрацювати параграф 24, виконати завдання 177.




